2. 广州医学院肿瘤学
在加速器的日常质控测量中, 照射野的半影、平坦度、对称性和离轴比的测量通常采用指型电离室进行, 由于指型电离室只能进行单点测量, 不但效率很低, 而且电离室测量位置较难精确控制。虽然, 加速器射野的半影、平坦度、对称性和离轴比也可用慢感光胶片进行测量, 但胶片测量过程中影响结果的因素众多, 其本身的质控工作十分繁锁。笔者通过比较MatriXX系统和传统设备所测结果的异同, 探讨应用二维空气电离室矩阵MatriXX系统进行放疗质控监测的准确性、可靠性和方便性。
1 材料方法 1.1 设备材料IBA二维空气电离室矩阵MatriXX及控制软件OmniProI'mRT系统, GELightSpeed16排螺旋CT, Philips Pinnac3 V8.0m计划系统, VarianClinac23EX医用加速器, X射线能量为6MV和15MV, 加速器多叶光栅(MLC)叶片数为120。Farmer型0.6cm3指形电离室, IBA固体水模块及用固体水和步进马达等自制的周期运动平台[1, 2], 测量结果绘图采用Matlab7.0软件进行。
1.2 测试准备将MatriXX系统通过网线与控制电脑相连, 开启电源, 为了使电离室输出信号稳定, 在正式测量前, 射野开至27cm×27cm对MatriXX预照10Gy剂量。预热后, MatriXX分别进行本底测量和采样时间设置, 对不同的照射剂量率(如200MU/min、300MU/min)设置不同的采样时间, 使MatriXX系统在采用"快照"测量方式时读数信号强度接近100%即可。
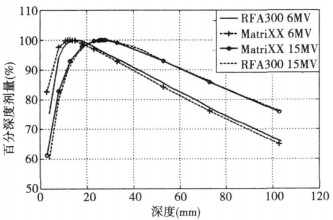
1.3 测百分深度剂量和组织最大比Varian23EX加速器能量选择6MVX射线和15MVX射线, 测百分深度剂量(PDD)时源皮距100cm保持不变, 测组织最大比(TMR)时源轴距固定为100cm。固体水模块厚度分别为1、2、5、10mm, 在剂量建成区域附近测量时, MatriXX表面覆盖的体模块厚度按1mm递增, 超过剂量建成区域后, 体模块厚度按10mm递增。开10cm×10cm方野, 每次照射50MU, 用MatriXX的"电影"测量模式进行累积测量, 照射完毕, 停止测量读数, 以射野中心点作为剂量归一点(100%), 得到每次照射读数, 测量完成后, 将所测数据与用RFA300三维水箱测量数据一起输入Matlab7.0软件中进行绘图, 结果如下图 1和图 2所示。
|
图 1 MatriXX在固体水中所测6MV和15MV X射线10cm×10cm射野的PPD曲线与RFA300三维水箱测试结果 |

|
图 2 MatriXX在固体水中所测6MV X射线10cm×10cm射野的TMR曲线与RFA300三维水箱测试结果 |
在用MatriXX进行绝对剂量测量前还必须先进行剂量刻度, 具体方法是:先用指形电离室和标准水箱, 按照常规方法在源皮距(SSD)为100cm时标定加速器10cm×10cm射野的输出剂量, 使其在最大剂量深度处为1cGy/MU。因MatriXX系统固有建成层厚度为3mm, 所以还要根据材料方法1.3中测量得到的最大建成深度, 在MatriXX表面覆盖一层固体水或其他等效材料, 使有效测量平面位于最大剂量深度处, 并在MatriXX底部放置6cm厚固体水模块作为反散射用, SSD设为100cm, 开10cm×10cm照射野, 照射100MU。按MatriXX系统剂量刻度步骤进行操作, 可得到剂量刻度修正因子, 这样MatriXX就可用于绝对剂量测量了。
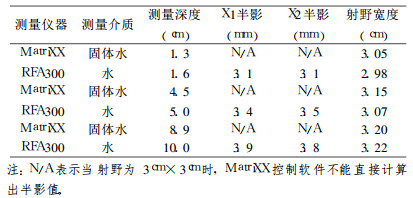
1.5 测量射野半影和野宽用MatriXX和固体水模块相结合, 测量6MVX射线的半影和野宽。测量方法:SSD设为100cm, 射野分别为3cm×3cm、5cm×5cm、10 cm×10cm, 测量深度分别为最大剂量深度(dmax)、5cm和10cm处。开启加速器出射线后, 用MatriXX系统的"快照"方式测量, 采样时间20ms, 采样后, 停止照射和读数, 用系统软件进行分析处理, 立即可得到相应射野的半影和野宽, 并将MatriXX所测数据与RFA300三维水箱扫描结果进行对比, 如表 1~3及图 3所示。
|
|
表 1 MatriXX和RFA300三维扫描水箱所测3cm×3cm方野的半影及野宽对比表 |
|
|
表 2 MatriXX和RFA300三维扫描水箱所测5cm×5cm方野的半影及野宽对比表 |
|
|
表 3 MatriXX和RFA300三维扫描水箱所测10cm×10cm方野的半影及野宽对比表 |

|
图 3 6MVX射线10cm×10cm射野在最大剂量深度处的离轴比: MatriXX和RFA300三维水箱测量结果对比 |
MatriXX置于自制剂量测量体模中进行CT扫描, 然后把所得CT图像传输到Pinnac3 V8.0m计划系统上, 以MatriXX测量平面中心点为等中心, 设计体模计划。将真实患者的调强放疗计划(静态调强和动态调强)移植到体模CT图像上, 保持射野参数不变, 重新进行剂量计算, 并计算出MatriXX测量平面的剂量分布, 将此剂量分布输入到MatriXX控制软件系统中, 按计划对体模实施照射, 用MatriXX测出不同调强计划照射时测量平面的二维剂量分布, 用OmniProI' mRT系统分析、比较其相互间的差异, 同时对实测剂量分布和计算剂量分布进行对比分析。数据分析方法包括:关键器官的点剂量和离轴比曲线比较, 同时, 对计算和实测的二维剂量分布进行Gamma分析[3](按剂量差3%, 距离差3mm为判别标准), 根据关键器官点剂量、离轴比曲线及Gamma分析结果, 综合判断病例计划是否可以用于患者的治疗。
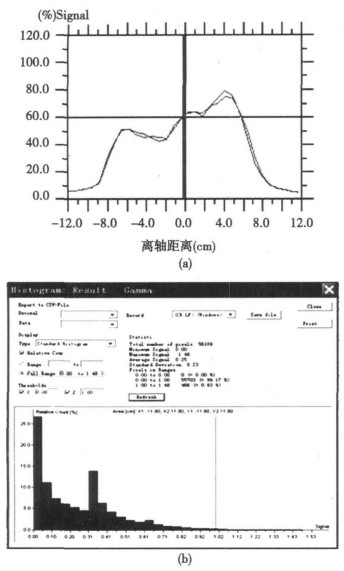
2 结果在MatriXX进行调强放疗计划验证时, 只需要按计划设计对体模和MatriXX进行摆位和照射, 照射完毕即可立即得到实测剂量分布及与计划剂量分布对比分析结果, 包括点剂量、离轴比和二维剂量分布的Gamma分析统计, 如图 4所示。
|
图 4 MatriXX测量同一患者的静态调强和动态调强剂量分布的离轴比曲线(a)和按3mm和3%的误差标准进行Gamma分析的统计直方图(b) |
随着放疗技术的发展, 三维适形放疗、调强放疗、图像引导放疗等新技术对放疗设备的质控工作不断提出新的要求, 基于单个指型电离室进行的点剂量测量和基于慢感光胶片的二维剂量分布验证工作日益受到严峻的考验, 传统测量方法固有的局限性使得质控工作变得十分繁重, 急需一种高效、准确、简便的测量方法和工具。鉴于此, 放疗界不断研究新的测量工具和测量方法, 以提高测量精度和测量效率。近几年发展起来的空气电离室矩阵MatriXX系统[4, 5]就同时具有点剂量和二维剂量分布实时在线测量的能力, 由1 020个空气电离室组成, 每个电离室的外直径4.5mm, 高5mm, 灵敏体积0.08ccm, 所有电离室等间距分布, 排列成32×32矩阵形式, 相邻电离室中心间距7.62mm, 有效测量范围24cm×24cm。MatriXX系统可以在最快20ms内完成剂量数据采集, 并采用并行处理技术, 无测量死时间, 其电离室体积小, 能量响应好, 灵敏度高。
从图 1和图 2中可见, 用MatriXX测量所得6MVX射线的PDD曲线和TMR曲线与RFA300三维水箱所测曲线基本平行; 而用MatriXX测量所得15MVX射线的PDD曲线与RFA300三维水箱所测曲线几乎重合(图 1)。说明用MatriXX在固体水模块中测量后经过简单的修正, 即可得到X射线的百分深度剂量和组织最大比。在日常质控工作中, 常要用指形电离室在标准水箱中临测10cm和20cm深度处的百分深度剂量值。由于水箱中水的深度靠目测判断, 不同的人处于不同的位置时读数会不一样, 给测量结果带来人为误差。但如果用MatriXX与固体水模块相结合进行测量, 由于固体水模块厚度可以精确控制, 这种误差自然可以消除, 使日常质控监测PDD和TMR变得十分方便、准确。另一方面, MatriXX在任何一次测量读数时, 均可同时测出二维平面剂量分布的各种指标, 给质控工作带来许多便利。
应用MatriXX进行调强放疗计划验证的最大优势在于其效率很高, MatriXX系统的摆位、刻度和数据分析的时间通常几分钟内可以完成。如果用慢感光胶片进行同样的相对剂量和绝对剂量测量工作, 需要进行胶片冲洗、胶片剂量响应曲线测量、电离室点剂量刻度, 还要使用昂贵的二维胶片剂量扫描仪系统建立胶片光密度和剂量的关系曲线, 最后才能比较、分析实测值与放疗计划系统计算值的异同, 整个过程环节众多, 费时费力, 通常需要几个小时[6], 而且慢感光胶片成本也不少。
与同类产品如MapCheck相比, 二维空气电离室矩阵MatriXX系统还具有灵敏度不随累计照射剂量的增加而改变的特点[6]。本研究及文献[7]结果表明, 对于射野的对称性、平坦度、野宽、重复性和输出因子的测量, MatriXX的测量结果与三维水箱扫描结果和指形电离室测量结果相符, 其精度完全可以满足日常质控的要求。
另一方面, 实验中也发现了MatriXX系统的一些不足, 与胶片系统相比, MatriXX系统的空间分辨率受其电离室矩阵的排列间距所限制, 其有效测量平面24cm×24cm范围内只有1020个其电离室, 按32×32矩阵形式等间距排列, 相邻电离室中心间距7.62mm, 而胶片剂量系统的空间分辨率可达亚毫米级。利用MatriXX进行半影测量时发现, 当射野小于3cm×3cm时, MatriXX系统软件不能自动计算出半影值, 其原因可能是:由于MatriXX系统中相邻电离室间距7.62mm, 当射野小于3cm ×3cm时, 整个照射区内电离室数目小于4个, 因此, 不能自动计算出半影值。同时, 二维空气电离室矩阵MatriXX系统在半影区内只可能有2~3个测量点, 不能精确的确定半影区域的离轴比曲线形状, 也就不能准确的计算出半影值来(图 3)。在本实验结果表明, MatriXX所测半影值比三维水箱扫描数值大许多, 约为2~3倍, 其原因正如上所述。
综上, 尽管MatriXX系统在空间分辨率上有所不足, 但与传统的指型电离室和胶片剂量系统相比, 在日常放疗质控测量中, 特别是调强放疗的二维平面剂量验证工作中, 二维空气电离室矩阵MatriXX系统具有简便、高效、准确的优势, 是一个较为理想的放疗质控测量设备。
| [1] |
张书旭, 周凌宏, 陈光杰, 等. 二维空气电离室矩阵MatriXX系统的应用研究[J]. 中华放射医学与防护杂志, 2009, 29(1): 100-103. |
| [2] |
张书旭, 徐海荣, 陈光杰, 等. 呼吸运动对靶区三维重建的影响[J]. 中国医学物理学杂志, 2006, 23(6): 400-404, 461. DOI:10.3969/j.issn.1005-202X.2006.06.002 |
| [3] |
Andenna C, Benassi M, Caccia B, et al. Comparison of dose distributions in IMRT planning using the gamma function[J]. J Exp Clin Cancer Res, 2006, 25(2): 229-234. |
| [4] |
Amerio S, Boriano A, Bourhaleb F, et al. Dosimetric characterization of a large area pixel-segmented ionization chamber[J]. Med Phys, 2004, 31(2): 414-420. DOI:10.1118/1.1639992 |
| [5] |
Herzen J, Todorovic M, Cremers F, et al. Dosimetric evaluation of a 2D pixel ionization chamber for implementation in clinical routine[J]. Phys Med Biol, 2007, 52(4): 1197-1208. DOI:10.1088/0031-9155/52/4/023 |
| [6] |
Jursinic P A, Nelms B E. A2-D diode array and analysis software for verification of intensity modulated radiation therapy delivery[J]. Med Phys, 2003, 30(5): 870-879. |
| [7] |
Wiezorek T, Banz N, Schwedas M. Dosimetric quality assurance for intensity-modulated radiotherapy feasibility study for a film less approach[J]. Strahlenther Onkol, 2005, 181(7): 468-474. |