人乳铁蛋白(human Lactotrans ferrin hLTF, human lactoferrin hLF)结构与运铁蛋白类似但铁亲和性更高, 在初乳中含量最高, 也存在于在泪液、唾液、粘液和中性粒细胞的次级颗粒。hLF由上皮和中性粒细胞合成, 炎性刺激后分泌。N端可结合脂多糖促进细菌细胞壁的通透性, 与螯合铁原子的特性结合可抑菌。hLF促进IL的合成与释放而活化中性粒细胞, 促进淋巴细胞增殖和补体激活来激活宿主免疫系统。hLF可紧密结合病毒外壳蛋白封闭其细胞病毒融合结构域, 从而抑制病毒感染[1]。作为非特异性性机体防御系统的一部分, 目前发现hLF可能对于肿瘤发生和转移具有抑制作用[2]。已经在动物试验和非小细胞肺癌临床观察发现具有抗肿瘤作用, 转移性肾癌的二期临床治疗研究[3]。因其低毒性和易吸收性, hLF可能将会是一个很好的抗肿瘤新药。目前hLF与肿瘤细胞放射敏感性的研究还未见报道, 本研究就hLF基因表达水平改变对非小细胞肺癌H460细胞的放射敏感性的影响, 作出初步的体外观察。
1 材料与方法 1.1 材料pBC1-hLF载体由本实验室构建, H460细胞购自中国医学科学院细胞中心。Celltiter-Glo (G756B)试剂盒购自Promega, 脂质体Lipofectamine2000购自Invitrogen。小鼠抗hLF单抗购自Abcam, hLF标准品购自Sigma (61326), 二抗购自北京中杉金桥。
1.2 方法 1.2.1 细胞培养和转染H460细胞以含10%胎牛血清的1 640培养基正常培养, 称H460对照组; 向培养基中添加hLF至10μM处理48h, 称hLF处理组; 选择指数生长期的H460细胞, 消化计数按1.0×106接种6孔板中, 正常培养至细胞90%融合后改用无血清Opti-MEM培养, 按Lipofectamine说明书转染, 12h后转为正常培养, 称pBC1-hLF转染组。
1.2.2 Western印记检测hLF表达水平检测样品经SDS/ PAGE (10%分离胶, 4%浓缩胶)电泳后, 半干转PVDF膜行蛋白印记检测, 一抗1:10 000稀释, 二抗1:2 000稀释, ECL显色显影, 内参β-actin, 结果见图 1。

|
图 1 pBC1-hLF转染后24h的western印记图 |
贴壁细胞照射时反置培养瓶, 137Csγ射线0.82 Gy/min照射2, 4, 8Gy。
1.2.4 细胞活力实验将各组受照细胞以每孔10 000个转移至不透光96孔板, 按照Celltiter说明书操作, 荧光发光仪读板, 积分时间0.25-1s, 记录数据作存活曲线图 2。

|
图 2 H460细胞活力曲线 |
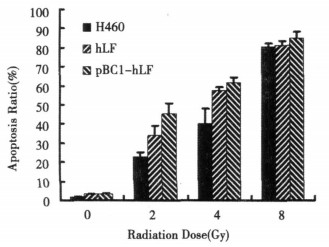
选择指数生长期的各组细胞, 照射后70%乙醇4℃固定, PBS洗2次, 加1mlPI工作液(PBS, 0.5 mg/mLRNaseA, 0.1 mg/mLPI), 流式检测细胞亚G1凋亡峰, 结果见图 3。
|
图 3 H460细胞凋亡率 |
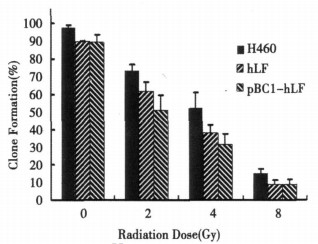
选择指数生长期细胞室温照射不同剂量后, 梯度稀释, 100个细胞每皿接种60mm培养皿, 培养至肉眼可见克隆时终止(约2~3周), 甲醇固定15min, 姬姆萨染色15min, 洗去染液, 干燥后显微镜下计大于50个细胞的克隆, 以对照组细胞贴壁率校正后计算克隆形成率。
1.2.7 统计方法LD50由ICp软件计算, 两组间差异性比较用Excel软件t检验, P < 0.05代表显著性。
2 结果 2.1 Western印记检测hLF表达水平图 1显示pBC1-hLF转染组24h的hLF表达比H460对照组增加。
2.2 细胞活力实验图 2显示与对照组比较, hLF处理组和pBC1-hLF转染组的受照存活率均显著下降(P < 0.01), LD50分别为:对照组3.78Gy; hLF处理组2.93 Gy; hLF转染组2.38 Gy。与对照组比较辐射增敏率分别为:hLF处理组1.29和pBC1-hLF转染组1.59。
2.3 流式细胞凋亡检测图 3显示2、4Gy照射后, 与对照组比较, hLF处理组和pBC1-hLF转染组凋亡显著增加(P < 0.01), 而8Gy组差异无统计学意义。
2.4 克隆形成实验图 4显示各组细胞受照后克隆形成能力的变化, 与对照组比较照射后克隆形成均显著下降(P < 0.05), 以pBC1-hLF转染组最显著(P < 0.01)。
|
图 4 H460细胞克隆形成率 |
人乳铁蛋白是铁结合蛋白, 具有抗菌和抗病毒活性[4], 最近发现hLF可抑制肿瘤形成[5]。目前还没有hLF与肿瘤细胞辐射敏感性的研究报道, 为探讨hLF对于人非小细胞肺癌细胞辐射敏感性的影响, 我们用pBC1-hLF载体转染H460细胞, 同时以培养基中加hLF标准品处理为参照, 观察hLF基因高表达对细胞生长特性和对于辐射的敏感性的影响。细胞活力实验说明hLF基因高表达可以显著抑制H460的生长, 提高其对射线的敏感性, hLF可促进H460细胞自发和受照后的凋亡, 降低克隆形成能力。
Bezault认为hLF可能通过激活包括NK细胞等淋巴细胞或提高靶细胞对于NK细胞的敏感性来抑制肿瘤形成[6]。Freiburghaus等发现乳铁蛋白肽段可以抑制降低人结肠癌细胞CyclinE1的表达而使细胞G1/S延迟, 降低肿瘤细胞增殖能力[7]。结合已有的报道, 我们推测hLF基因在体外培养的H460细胞中高表达, 可能也通过细胞周期信号通路以及辐射损伤信号通路的交互作用, 将损伤细胞阻滞于细胞周期并诱导凋亡。
上述关于hLF对于人非小细胞肺癌H460细胞辐射敏感性影响的初步研究结果, 将促进我们继续更加深入的研究hLF基因肿瘤抑制作用的可能机制。
| [1] |
Wakabayashi H, Yamauchia K, Takasea M. Lactoferrin research, technology and applications[J]. International Dairy Journal, 2006, 16(11): 1241-1251. DOI:10.1016/j.idairyj.2006.06.013 |
| [2] |
Rodrigues L, Teixeira J, Schmitt F, et al. Lactoferrin and cancer disease prevention[J]. Crit Rev Food Sci Nutr, 2009, 49(3): 203-217. |
| [3] |
Jonasch E, Stadler W M, Bukowski R M, et al. Phase 2 trialo f talactoferrin in previously treated patients with metastatic renal cell carcinoma[J]. Cancer, 2008, 113(1): 72-77. |
| [4] |
Lönnerdal B. Nutritional roles of lactoferrin[J]. Curr Opin Clin Nutr Metab Care, 2009, 12(3): 293-297. DOI:10.1097/MCO.0b013e328328d13e |
| [5] |
Iigo M, Alexander D B, Long N, et al. Anticarcino genesis pathways activated by bovine lactoferrin in the murine small intestine[J]. Biochimie, 2009, 91(1): 86-101. DOI:10.1016/j.biochi.2008.06.012 |
| [6] |
Bezault J, Bhimani R, Wiprovnick J, et al. Human lactoferrin inhibits growth of solid tumors and development of experimental metastases in mice[J]. Cancer Res, 1994, 54(9): 2310-2312. |
| [7] |
Freiburghaus C, Janicke B, Lindmark M, nsson H, et al. Lactoferricin treatment decreases the rate of cell proliferation of a human colon cancer cell line[J]. J Dairy Sci, 2009, 92(6): 2477-2484. DOI:10.3168/jds.2008-1851 |



