随着对细胞信号传导通路复杂性了解的不断深入, 以往的研究单个生物分子的方法已经不能很好的解决此类问题。基因芯片技术提供了一种可以实时检测数千乃至数万个基因表达变化的手段, 已有实验室建立了专门检测电离辐射信号传导通路的基因芯片技术[1], 但对肿瘤细胞照射前后表达谱变化研究国内鲜见报道。放射治疗在肿瘤临床治疗中占有举足轻重的地位, 是继手术之后的第二大治疗手段, 约70%的患者在治疗过程中需要放疗。对早期头颈部肿瘤如鼻咽癌、喉癌、口咽癌、下咽癌等, 单独放疗可取得和根治术同样的效果[2], 但也有部分类型的头颈部肿瘤对电离辐射不敏感, 表现为临床放射治疗的效果欠佳。本实验选用对辐射不敏感的人口腔上皮癌KB细胞, 利用芯片技术对比照射前后肿瘤细胞表达谱变化, 寻找与辐射抵抗或敏感相关的基因或基因组, 并分析照射后细胞调控信号通路的改变。从而为进一步开展相关分子功能研究, 阐述辐射抗性产生的机制, 提高肿瘤治疗效果提供理论基础。
1 材料和方法 1.1 主要试剂和仪器RPMI1640培养液, 新生牛血清(Gibco 公司), 六孔贴壁细培养板(Corning 公司), Trizol (Invitrogen 公司), 二氧化碳培养箱(HEPA class 100), 倒置显微镜(CK40-F200, OLYMPUS 公司), 直线加速器(KD-2, Siemens 公司), Illumina Totalprep试剂盒, 其中包括dNTPs、杂交试剂、反转录酶、反转录引物、反转录酶缓冲液、DTT、Cy5-dCTP和Cy3-dCTP、标记试剂Ⅰ、Ⅱ、Ⅲ、洗片剂1、2、3等(Illumina公司), 基因芯片(Human-6 V2, Illumina公司), 芯片扫描仪(BeadSation, Illumina公司)。
1.2 细胞培养人口腔表皮样癌KB细胞系购于中科院上海细胞库, 培养于含15%新生牛血清的RPMI1 640培养液中, 另加15mmol/LHEPES, 2.2g/L碳酸氢钠, 2mmol/L谷氨酰胺。细胞置于37℃含5% CO2湿饱和的培养箱中培养, 每3d传代1次。
1.3 克隆形成分析取对数生长期的KB细胞胰蛋白酶消化并制成单细胞悬液, 预实验结果中细胞贴壁率为30%左右, 且高剂量组成克隆数大于50, 故选择接种细胞数800个/孔于6孔贴壁细胞培养板, 用直线加速器产生的6MeVX射线进行照射, 剂量率200cGy/min, 源皮距100cm, 照射剂量为0、2、4、6、8Gy。继续培养9d, 3d换一次液。9d后细胞用95%乙醇固定, 姬姆萨染色, 计数≥ 50个细胞的克隆数。以克隆数计算细胞生存分数(SF)。

|
应用Sigma Plot 2001 Demo版软件, 以多靶单击模型S=1- (1-eDo/D) n, Dq=D0 · 1nN拟合细胞存活曲线, 计算放射敏感性参数:D0值代表平均致死量、Dq值代表准阈剂量。
1.4 基因芯片的检测与分析由克隆实验结果, 选择6Gy剂量在相同照射条件下照射已贴壁生长的细胞, 设空白对照组。10h后用Trizol试剂提取两组细胞总RNA。752紫外分光光度计在260nm及280nm波长下测定吸光值, 分析RNA纯度和浓度。采用Illumina Totalprep试剂盒得到纯化的cRNA, 用Streptavidin-Cy3染色后将样品与杂交混合液混合后, 加样到芯片上, 55℃反应16h进行杂交, 洗片后用芯片扫描仪扫描, 转换为灰度TIFF格式的图片文件保存。运行ScanAlyze软件, 将灰度TIFF格式图片的点阵转化为数字型数据, 使用芯片配套软件GEArray Analyzer对原始数据进行去背景计算以及比较运算。然后对芯片上的数据用Cubic Spline方法进行归一化处理, 筛选出与对照组差异表达基因。
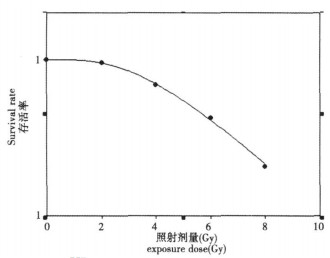
2 实验结果 2.1 电离辐射对细胞抑制作用不同剂量的射线照射后KB细胞存活曲线见图 1。D0、Dq值分别为2.52±0.34, 4.87± 0.12。因Dq值为4.87±0.12, 基因芯片实验中提取总RNA时细胞生长时间短于克隆形成时间, 故选择6Gy剂量点照射。
|
图 1 KB细胞存活曲线 |
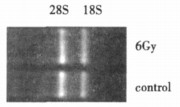
对照组D260/D280值为1.94, 照射组D260/D280值为1.94, 总RNA28S的亮度约为18S的两倍, 说明总RNA的质量良好, 见图 2。
|
图 2 RNA琼脂电泳图 |
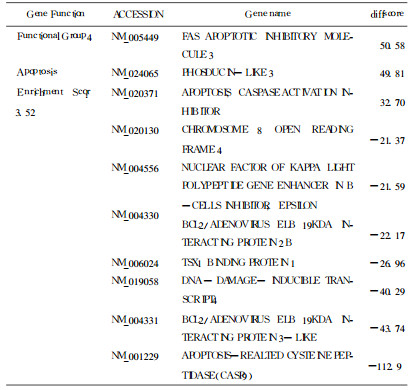
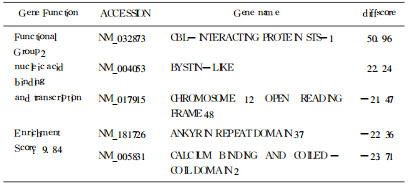
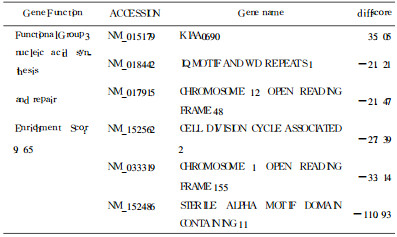
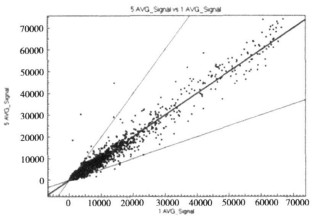
采用含有48 000个人源基因的oligo芯片, 差异基因的筛选标准为实验组与对照组其中任何一组中为有效基因, 且实验组差异分值(Diffscore)值小于-20或大于20。得到749个表达差异基因, 其中上调表达的有269个, 下调表达的有480个, 杂交信号数据散点图见图 3。X轴Y轴分别以对照组和实验组的荧光强度信号为坐标, 每一个数据点代表芯片上一个基因点的杂交信号。此749个基因中有功能分类的691个, 利用DAVID Bioin formatics Resources (http://david.abcc.ncifcrf.gov)中基因分类功能可以把其按功能分为37组, 主要涉及细胞分裂、核酸合成修复、核酸结合转运、调亡等功能。这些功能所包括的部分差异表达基因见表 1-4 。用GenMAPP数据管理器(expression dataset manager)对差异表达的此四类功能基因行pathway分析, 发现在细胞分裂及凋亡的已知通路中分别有5个和3个基因出现了差异表达, 在细胞分裂通路中差异表达的基因有:PTTG1(Pituitary tumortrans forming 1)、CDC20(Cell division cycle20 homolog)、CDC25c (cell division cycle 25c)、PLK1(Polo-like kinase 1)、E2F1(E2F transcription factor 1), 在细胞凋亡通路中差异表达的基因有: Caspase-9、NFKBIE。
|
图 3 基因表达信号散点图 |
|
|
表 1 细胞分裂相关部分差异表达基因 |
|
|
表 2 凋亡相关部分差异表达基因 |
|
|
表 3 核酸结合转运相关部分差异表达基因 |
|
|
表 4 核酸合成修复相关部分差异表达基因 |
利用射线杀灭肿瘤细胞是临床上治疗肿瘤的重要手段, 甚至已成为某些头颈部肿瘤早期治疗的首选方式。电离辐射可以引起许多哺乳类细胞中多达数百种基因变化, 其中有一些可能是电离辐射触发的非特异性损伤的"共同通路"反应基因, 另一些则是特异性对辐射损伤反应[3], 在本实验差异表达的基因中, 通过对功能已知基因的分析, 发现电离辐射能对细胞分裂、核酸合成与修复、核酸结合与转运, 细胞凋亡等多个方面功能产生影响, 说明KB细胞辐射敏感或抗性的产生和这些功能的变化关系密切。
细胞分裂是一个由多因子共同调控的有序过程, 在已知的细胞分裂信号传导通路中, 有5个基因在本实验中显示差异表达。PTTG1也命名为Securin, 是从大鼠垂体肿瘤中发现的癌基因[4], PTTG1在细胞周期进程、DNA修复和凋亡等生理过程中均发挥重要作用[5-7]。在有丝分裂过程中, PTTG1结合在姐妹染色单体上, 在分裂中期末被降解, 使得姐妹染色体分离[5]。有文献报道, 促进PTTG1的降解, 可达到治疗肿瘤的目的[8]。
CDC20是纺锤体组装检查点的靶向物和有丝分裂后期促进复合体(Anaphase-promotingcomplex, APC)的正调控因子, 在引导细胞周期中某些蛋白质的泛素化降解和确保染色体正常分离的过程中发挥作用[3]。CDC20的过多表达能造成细胞分裂异常[9]。
CDC25c是CDC25家族三种成员之一, 它在细胞中定位广泛, 具体取决于细胞核信号的输出[10]。磷酸酶CDC25c能特异性水解有丝分裂促进因子cyclinB/cdk1中Thr14和Thrl5两位点磷酸根, 使其活化, 以此来启动G2/M期的转换[11]。
PLK1为polo样激酶家族的成员之一, 是一种呈周期性依赖表达的丝/苏氨酸激酶, PLK1主要参与细胞有丝分裂调控:通过磷酸化下游底物CDC25c促进cyclinB/Cdc2的激活, 协助中心体的功能成熟和双极性纺锤体的形成, 调节促后期复合体APC参与有丝分裂晚期事件, 以及影响胞质分裂等[12], PLK1是细胞进入并维持有丝分裂诸事件直至分裂完成的一不可或缺的分子。
E2F1是转录因子E2F家族成员之一, 是一种细胞转录活化因子, 它在G1中后期因pRB的磷酸化而被释放出来, 并通过影响G1/S期过渡所需的蛋白表达和DNA合成来调节细胞周期的运行, 因此被认为是细胞由G1期进入S期最重要的转录因子[13]。
在这五个基因中, 除E2F1是作用于G1/S期以外, 其余四个基因全部是作用于G2/M期, 并呈下调表达趋势。此4个基因的下调表达, 可能使细胞停滞在对射线敏感G2/M期, 使细胞分裂无法顺利进行, 从而对细胞造成损伤, 表现为对辐照敏感。
细胞凋亡是一种由基因调控的细胞主动死亡过程, 是机体生长发育、细胞分化、生理及病理性死亡的重要机制。Caspase -9是凋亡过程的核心分子, 属于Caspase蛋白酶家族, Caspase蛋白酶家族能通过级联反应来启动凋亡过程。Caspase分子原先都是以无活性的形式存在于细胞中, 凋亡外界信号只作用于Caspase前体。Caspase-9的前体Procaspase-9参与凋亡复合体(Apoptosome)的形成, 在复合体内, Procaspase-9可自身激活形成活化的Caspase-9, 从而使细胞凋亡[14]。
NFKBIE属于IκB (InhibitorsofNF-κB)家族。IκB能够抑制NF-κB (Nuclearfactor-κB)的活性, 在未受刺激的细胞内, NF-κB以无活性形式与DNA结合, 当受到外来刺激, IκB被磷酸化后NF-κB被释放, 并通过诱导抗凋亡基因表达或抑制前调亡基因表达来调控凋亡[15]。
在凋亡通路中, Caspase-9下调表达, NFKBIE上调表达, 可以共同促进抗凋亡作用产生。同时, 辐射敏感基因P53在本次实验中表达水平未变化, 都可能与KB细胞对辐射相对不敏感有关。
基因表达谱的数据是海量的, 通过对一系列差异表达基因的分析, 我们对辐射引起的复杂反应有了一个总体的了解, 为下一步选择合适的辐射敏感或抗性产生基因进行系统研究提供了参考。
| [1] |
Amundson S A, Bittemer M, Meltzer P, et al. Induction of gene express as amonitor of exposure to ionizing radiation[J]. Radiat Res, 2001, 156(5): 657-661. DOI:10.1667/0033-7587(2001)156[0657:IOGEAA]2.0.CO;2 |
| [2] |
刘武, 闫文娴, 莫膨涛. 放疗在头颈部癌症临床治疗中的作用[J]. 实用肿瘤学杂志, 2008, 22(3): 282-285. DOI:10.3969/j.issn.1002-3070.2008.03.030 |
| [3] |
Fomace A J. Mammalian genes induced by radiation; axtivation of genes associated with growth control[J]. Ann rev genet, 1992, 26: 507-526. DOI:10.1146/annurev.ge.26.120192.002451 |
| [4] |
Zhang X, Horwitz G A, Prezant T R, et al. Structure, expression, and function of human pituitary tumor-transforming gene(PTTG)[J]. Mol Endocrinol, 1999, 13(1): 156-166. DOI:10.1210/mend.13.1.0225 |
| [5] |
Zou H, McGarry T J, Bernal T, et al. Identification of a vertebrate sister-chromatid separation in hibitor involved intrans formation and tumori genesis[J]. Science, 1999, 285: 418-422. DOI:10.1126/science.285.5426.418 |
| [6] |
Kim D S, Franklyn J A, Smith V E, et al. Securin induces genetic instability in colorectal cancer by inhibiting doubles tranded DNA repair activity[J]. Carcino genesis, 2007, 28: 749-759. |
| [7] |
Bernal J A, Luna R, Espina A, et al. Human securin interacts with p53 and modulates p53-mediated transcriptional activity and apoptosis[J]. Nature Genetics, 2002, 32: 306-311. DOI:10.1038/ng997 |
| [8] |
Mao Zh, Zuaxy, Xiea Zh, et al. Antitumor effect of F-PBFβ -TrCP-inducedt argeted PTTG1 degradation in HeLa cells[J]. J.Biotechnol, 2009, 139: 6-11. DOI:10.1016/j.jbiotec.2008.09.004 |
| [9] |
Mondal G, Sengupta S, Panda C K, et al. Overexpression of Cdc20 leads toimpairment of the spindle assembly checkpoint and aneup loidization in oral cancer[J]. Carcinogenesis, 2007, 28(1): 81-92. |
| [10] |
Takizawa C G, Morgan D O. Control of mitosis by changes in the subcellular location of cyclin-B1-Cdk1 and Cdc25C[J]. Curr Opin Cell Biol, 2000, 12: 658-665. DOI:10.1016/S0955-0674(00)00149-6 |
| [11] |
Busch C, Barton O, Morgenstern E, et al. The G2/M checkpoint phosphatase cdc25C is located within centrosomes[J]. The International Journal of Biochemistry & CellBiology, 2007, 39: 1707-1713. |
| [12] |
Lowery D M, Lim D, Yaffe M B. Structure and function of Polo -like kinases[J]. Oncogene, 2005, 24: 248-259. DOI:10.1038/sj.onc.1208280 |
| [13] |
Dimova D K, Dyson N J. The E2F trans criptional network:old acquaintances with new faces[J]. Oncogene, 2005, 24(17): 2810-2826. DOI:10.1038/sj.onc.1208612 |
| [14] |
Kelvin Cain, Shawn B, Bratton, et al. The Apaf-1 apoptosome:a large caspase-activating complex[J]. Biochimie, 2002, 84: 203-214. DOI:10.1016/S0300-9084(02)01376-7 |
| [15] |
Tergaonkar V, Correa R G, Ikawa M, et al. Distinct roles of IkB proteins in regulating constitutive NF-kBactivity[J]. Nat Cell Biol, 2005, 7: 921-923. DOI:10.1038/ncb1296 |



 ,
,