2. 苏州大学附属第一医院肿瘤放疗科;
3. 苏州大学 医学部放射医学与公卫学院;
4. 苏州大学医学部基础医学系
临床中放射性脑损伤患者中学习记忆力损伤是最为常见且为较早期表现之一, 且放射引起的急性反应中发生的事件在晚期放射损害的发病原理中起着重要的作用[1]。研究表明早期应用镁剂对多种类型的脑损伤引起的功能障碍都能起到改善预后的作用。本实验拟通过建立半脑照射模型, 观察硫酸镁对早期射线照射引起的学习记忆功能损伤和海马结构神经细胞功能基因c-fos表达的影响, 以探讨硫酸镁的神经保护作用及可能的作用机制, 为临床应用治疗早期放射性脑损伤提供实验依据。
1 材料与方法 1.1 实验动物及分组清洁级成年Sprague.Dawley (S-D)大鼠(80~100日龄), 重(200±20) g, 雌雄各半, 由苏州大学动物实验中心提供。在建立照射模型之前用Y-迷宫(MG-2型, 江苏三兴声电公司)测试对大鼠进行预选。选择相对活跃、对电击反应敏感、逃避反应迅速的大鼠90只, 于安静、温暖(22℃)的环境中饲养48 h, 随机分为对照组(26只, 不予照射)、照射组(32只, 20 Gy半脑照射)和照射加药组(32只, 20 Gy半脑照射加用硫酸镁处理)。在每组大鼠在照后2、24 h用免疫荧光组织化学技术观察大鼠海马结构Fos蛋白表达(每时间点4只), 其余大鼠分别在照后第1、4、8周行Y-迷宫训练, 测试其学习记忆能力(每个时间点对照组6只, 另二组8只)。
1.2 放射性脑损伤模型制作将大鼠腹腔注射3.6%水合氯醛(1ml/100g)麻醉后、俯卧固定于自制"工"型木架上。用直线加速器5MeV (西门子PRIMUS)电子线对照射加药组和照射组大鼠随机选择一侧半脑垂直照射, 剂量率为300cGy/min, 源皮距100cm, 在10cm×l0cm的限光筒特制的铅模中, 照射野大小为1.5cm×2.0cm, 避开眼球, 照射野中心轴深度剂量的R85 (假定R85为治疗深度Rt)为12.5~16.7mm。照射前应用指型电离室(FarmerFC 23-C)在水下lcm作吸收剂量的测量。于照射之前校正, 保证受照侧脑组织吸收剂量为20Gy。对照组只麻醉, 不予照射。
1.3 给药条件对照射加药组大鼠缓慢腹腔注射10%的MgSO4, 照射前1d、照射前30min、照射后即刻及照后连续5d共给药七次, 剂量为400mg/kg体重。对照组和照射组腹腔注射同等量生理盐水。
1.4 免疫荧光组织化学检测Fos蛋白表达每组分别取4只大鼠在照后2h和24h, 经麻醉后迅速开胸进行灌流、固定、沉糖、切片, 之后加入兔抗Fos多克隆抗体(1:500, 美国.Santa Cruz公司)和FITC标记的驴抗兔IgG (1:200, 美国Jackson Immuno Research Lab公司), 切片经漂洗、裱片、晾干、透明、封固后在倒置荧光显微镜(日本Nikon公司, TE2000)下观察。用0.01 mol/LPBS代替一抗进行对照染色, 结果为阴性。选取相同部位的脑片(每只不少于3张), 在10×40倍显微镜下观察并计数海马结构Fos阳性细胞数。
1.5 Y-型迷宫测试学习记忆能力大鼠Y-迷宫测试采用随机不休息法"[2]略作改进。之前的处理同筛选相同。如果受到电击后大鼠5s之内一次性逃避至安全区, 就被视为"正确反应", 超时或向所在起步区逆向逃窜及先逃向错误臂均视为错误反应"。连续10次电击中有9次(9/10)"正确反应"的即达到学会标准。以大鼠在学会之前所受到的电击次数(即尝试次数)表示其学习成绩。达到学会标准后24h, 同法测试记忆能力, 给于电击15次, 以其中"正确反应"次数作为记忆成绩。实验在黑暗、安静的环境中进行。
1.6 病理形态学观察 1.6.1 尼氏染色(Nissl'sstaining)将大鼠麻醉后快速、完整取脑, 经4%的多聚甲醛固定后, 用1%甲苯胺蓝进行尼氏染色, 光学显微镜下观察。
1.6.2 超微结构从大鼠脑组织分离出照射侧海马结构, 2.5%戊二醛固定, 透射电镜观察。
1.7 统计学处理用SPSS13.0统计软件包进行单因素方差分析, 所有数据以均数±标准差(x±s)表示, 以P < 0.05为差异有统计学意义。
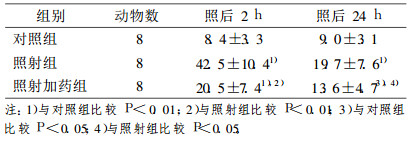
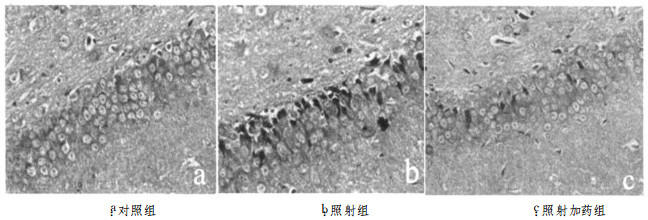
2 结果 2.1 硫酸镁对放射性脑损伤大鼠海马结构Fos蛋白表达的影响(表 1)Fos蛋白在海马结构中主要表达在海马锥体细胞和齿状回颗粒细胞的胞核中。荧光显微镜下观察Fos阳性细胞免疫产物呈绿色卵圆形, 边缘光滑。对照组海马结构Fos阳性细胞数很少(见图 1a)。20Gy照射后2h, 照射组Fos阳性细胞数表达明显增多, 尤以海马结构齿状回阳性细胞数增多最为显著(见图 1b), 其次是海马CA3区, 其余各区亦有少量表达。照射后24h, 阳性细胞数已明显减少。给予硫酸镁后Fos阳性细胞数目较照射组减少(见图 1c)。由表 1可见, 照射后2h和24h, 照射组大鼠海马结构Fos阳性神经元较对照组增多, 差异有统计学意义(P < 0.01);照射加药组Fos阳性神经细胞数目明显低于照射组(P < 0.05), 与正常对照组相比差异亦有统计学意义(P < 0.05)。
|
|
表 1 大鼠海马结构Fos蛋白表达情况(个/视野, x±s) |

|
图 1 大鼠20Gy半脑照射后2h照射侧海马结构齿状回Fos蛋白表达(免疫组织荧光染色, ×400) |
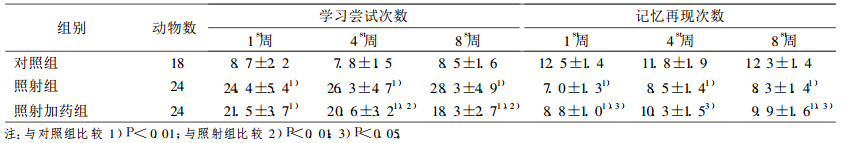
对照组大鼠无学习记忆障碍。受照后的大鼠对迷宫电刺激反应迟钝, 错误反应次数增多。与对照组相比, 照射组大鼠半脑照射后学习尝试次数增加、记忆再现次数较对照组减少, 两者均有统计学意义, 说明20Gy照射后早期可引起大鼠学习、记忆功明显降低(P < 0.01)。与照射组相比, 照射加药组大鼠学习尝试次数减少(第4和8周, P < 0.05), 记忆再现次数增加(P < 0.05)。说明早期给予硫酸镁治疗可在一定程度上改善放射性脑损伤大鼠早期的学习、记忆功能。
|
|
表 2 照射后各时间点大鼠Y-迷宫测试学习和记忆成绩(次, x±s) |
光镜下, 对照组(见图 2, a)海马结构神经细胞之间排列紧密, 境界清晰, 胞核大而圆, 轮廓清晰, 胞膜完整。照射后1周, 照射组大鼠海马结构中神经细胞发生急性肿胀、核周间隙增大, 细胞核染色加深、体积缩小、轮廓模糊, Nissl体减少, 呈早期凋亡表现, 随时间延长, 损伤逐渐加重, 照射后4周神经细胞排列稀疏、呈疏松筛网状, 大量神经细胞胞核固缩深染成不规则形状, Nissl体溶解消失, 呈明显的凋亡表现, 有的神经细胞溃变后被胶质细胞吞噬(见图 2, b)。后期部分变性坏死的细胞溶解消失, 海马结构细胞数目减少, 细胞层变薄。海马结构中以齿状回颗粒细胞受射线损伤最严重, CA3、CA1区次之。与照射组相比, 照射加药组海马结构中神经细胞周围间隙增大不明显, 细胞染色较淡, 体积缩小不明显, 亦有核固缩, Nissl体消失等凋亡表现, 但损伤细胞数目较少, 损伤程度明显减轻(图 2, c)。
|
图 2 大鼠20Gy半脑照射后4w海马结构神经细胞观察(尼氏染色, 光镜×400) |
照射组大鼠受照后早期, 细胞粗面内质网扩张, 核周间隙扩张, 核膜尚完整, 细胞核无明显变化。照后4周神经细胞表现为胞核核膜不清, 局部空泡变性, 线粒体肿胀, 内嵴减少或消失。小胶质细胞核内染色质浓聚, 溶酶体增加并吞噬坏死物质形成脂滴, 呈急性变表现。照射后8周, 神经细胞病变进行性加重, 胞核轮廓不清, 核膜断裂, 核染色质暗染。胞质内线粒体肿胀呈空泡状, 粗面内质网减少, 溶酶体增加, 尼氏体溶解(图 3, a)。星形胶质细胞核染色质边集浓聚, 线粒体肿胀, 粗面内质网扩张, 呈典型凋亡表现(图 3, b)。少突胶质细胞周围髓鞘板层分离。给予硫酸镁后神经细胞损伤减轻, 核内染色质聚集不明显, 线粒体肿胀较轻(图 3, c); 星形胶质细胞核肿胀, 核周水肿、胞浆空泡化, 凋亡表现不明显(图 3, d); 少突胶质细胞只有轻度脱髓鞘表现。

|
从病理形态学上可以看出, 及时给于镁离子可减轻大脑受辐射后引起的神经细胞的损伤。
3 讨论C-fos是即早基因(Immediately early gene, IEG)家族中的一员, 其表达与神经细胞凋亡在分布、时程和数量上具有一定的相关性, 且c-fos表达的时间在细胞凋亡发生形态及生化变化之前, 因此c-fos表达可作为细胞兴奋损伤进展的标志[3]。通常认为海马结构是记忆之门, 海马区神经细胞的丢失可能与神经功能障碍及学习记忆力下降有关, 海马结构神经细胞对辐射高度敏感, 故可作为评价放射性脑损伤的治疗疗效的可靠指标。经过改良的Y-型迷宫测试方法可同时观察逃避条件反射和空间辨别的能力, 是一种能较客观反映和评价空间学习记忆能力的测定方法[4]。
实验中观察到, 半脑照射后2h时海马结构Fos阳性细胞数目已有明显增加, 24h时却已明显下降, 这符合c-fos作为即早基因其反应迅速而短暂的特点。从行为学结果表明, 大鼠脑组织受照后早期学习和记忆能力降低。另外细胞放射损伤的严重程度与海马结构中c-fos的表达在区域上呈较强的相似性, 联系神经功能方面学习记忆能力的下降, 提示Fos蛋白的过度表达可能是引发海马结构神经细胞病理性损伤最后导致学习记忆障碍的启动环节之一。应用硫酸镁进行干预后, 放射性脑损伤大鼠海马结构Fos阳性细胞数目明显降低, 病理形态学上亦可观察到海马结构神经细胞损伤程度明显减轻, 这说明硫酸镁可能通过降低Fos蛋白表达减轻海马结构神经细胞继发性放射损伤。
镁离子是包括脑外伤、弥漫性轴索损伤等各种脑损伤中有效的神经保护剂[5, 6], 它在维持细胞膜上Na+-K+-ATP酶的活性, 保持膜完整性, 调节通透性及防止钙超载, 抑制兴奋性氨基酸释放, 改善颗粒细胞的电生理状态等方面发挥细胞保护作用。RobertVink[7]等发现镁剂可以改善外伤性脑损伤引起的运动神经功能和认知功能障碍。细胞外低镁可通过激活蛋白激酶C (Proteinkinasec, PKC), Ca2+通道激活, 诱导c-fos表达[8]。电离辐射引起脑组织损伤的病理过程是非特异性的, 神经细胞受到射线照射后迅速表达Fos蛋白的现象提示神经细胞在受到伤害性刺激时早期可能已有兴奋性氨基酸受体及钙通道的激活; 镁离子可能通过非竞争性抑制NMDA受体及PKC, 阻断Ca2+内流, 减轻钙超载[9]等途径, 抑制放射引起的神经细胞Fos蛋白的表达。
本次试验研究表明:硫酸镁可能通过改善海马结构的功能状态, 减轻细胞损伤, 起到改善早期放射性脑损伤大鼠学习和记忆功能障碍的作用; 降低Fos蛋白表达可能是硫酸镁发挥细胞保护作用的一个切入点。当然硫酸镁是否尚能通过其它途径在放射性脑损伤中发挥神经保护作用尚待进一步研究。
| [1] |
Rubin P, Jonhson C J, Williams J P, et al. Aperpetual cascade of cytokines post irradiation leads Kass IS to pulmonary fibrosis[J]. Int J Radiat Oncol Biol Phys, 1995, 33(1): 99-109. DOI:10.1016/0360-3016(95)00095-G |
| [2] |
王跃春. 大鼠Y-型迷宫测试法的筛选与优化[J]. 中国行为医学科学, 2005, 14(1): 50-52. DOI:10.3760/cma.j.issn.1674-6554.2005.01.018 |
| [3] |
Dragunow M, Robertson H A. Brain injury inducesc-fos protein(s)in nerve and glial-like cells in adult mammalian brain[J]. Brain Res, 1988, 455(2): 295-299. DOI:10.1016/0006-8993(88)90088-1 |
| [4] |
余建, 黄育文, 陈忠. 经过改良的评价大鼠空间记忆能力的交替电刺激Y型迷宫[J]. 浙江大学学报:医学版, 2003, 32(2): 121-125, 140. |
| [5] |
Heath D L, Vink Robert. Magnesium sulphate improves neurologic outcome following severe closed head injury in rats[J]. Neurosci Lett, 1997, 228(3): 175-178. DOI:10.1016/S0304-3940(97)00394-7 |
| [6] |
Smith D H, Okiyama K, Gennarelli T A, et al. Magnesium and ketamine attenuate congnitive dysfunction following experimental brain injury[J]. Neurosci Lett, 1993, 157(2): 211-214. DOI:10.1016/0304-3940(93)90739-8 |
| [7] |
Vink Robert, O'Connor C A, Nimmo A J, et al. Magnesium at tenuates persistent functional deficits following diffuse traumatic brain injury in rats[J]. Neuroscience Letters, 2003, 336(1, 9): 41-44. |
| [8] |
Kass I S, Cottrell J E, Chambers G. Magnesium and cobalt, not nimodipine, protect neurons against anoxic damage in the rathippocampal slice[J]. Anesthesiology, 1988, 69(5): 710-715. DOI:10.1097/00000542-198811000-00012 |
| [9] |
涂彧, 周菊英, 王利利. MgSO4对大鼠急性放射性脑损伤后钙超载的抑制作用[J]. 中华放射医学与防护杂志, 2005, 25(4): 339-341. DOI:10.3760/cma.j.issn.0254-5098.2005.04.012 |



 ,
,