2. 山西省中医研究院
在胸部肿瘤的放射治疗中,放射性肺损伤是常见的并发症,放射性肺损伤干扰放疗的正常进行, 影响放射治疗的效果和病人的生活质量,严重者可发生呼吸功能障碍甚至死亡。放射性肺损伤分为放射性肺炎和放射性肺纤维化两个阶段,而放射性肺纤维化的发生,往往是不可逆的[1]。因此,预防放射性肺炎就成为预防放射性肺损伤的重要途径。研究表明糖皮质激素对于间质性肺炎有一定的治疗作用并在临床实践中得到证实; 那么,它对于放射性肺损伤的作用又如何呢,本课题将通过探讨甲强龙对放射性肺损伤的防治作用。
1 材料与方法 1.1 实验材料 1.1.1 实验动物健康雄性新西兰兔45只,由山西省畜研所动物实验中心提供,体重2.5 ~3.0kg。
1.1.2 试剂甲强龙粉针剂(美国辉瑞投资有限公司生产);抗兔TGFβ1试剂盒(武汉博士德生物工程有限公司生产);山羊抗兔IgG(武汉博士德生物工程有限公司生产);
1.2 实验方法 1.2.1 动物分组和给药方法将新西兰兔45只,采用随机表来分组, 将动物编好号,按随机表顺序安排入各组,随机分为空白对照组(a)、单纯照射组(b)和照射加甲强龙组(c), 每组15只。a组不做任何处理, b组从照射开始后第一天起腹腔内注射生理盐水0.1ml/kg/d, 连用4周,c组从照射开始后第一天起腹腔内注射甲强龙注射液,0.4mg/kg/d, 连用4周。
1.2.2 照射方法将兔采用0.4%戊巴比妥(10ml/kg)肌肉注射麻醉。在麻妥后用自行设计的兔固定架将新西兰兔仰卧位固定, 在模拟定位机下定位,设2cm×2cm野,用加拿大产钴- 60治疗机γ射线照射右下肺, 源皮距80cm, 最大剂量点为皮下0.5 cm,照射剂量5Gy/次,1次/d, 5次/周,总剂量25Gy。
1.2.3 实验观测指标 1.2.3.1 CT扫描采用0.4%戊巴比妥(10ml/kg)肌肉注射麻醉,待新西兰兔肌肉完全松弛后,取仰卧位固定于自制的固定架上。于照射后的第1、3、5月,每次每组取5只动物进行CT扫描。之后采用盲法原则,由3位不知研究具体内容影像专家单独阅片,意见相同的为阳性诊断,否则为阴性诊断。
1.2.3.2 光镜标本的制备放疗后1个月,3个月和5个月,每组采用颈椎脱臼方法处死5只兔子,开胸取出右肺组织,观察肺脏组织的大体变化,并做记录。取部分肺组织放入10%的中性福尔马林溶液中固定,再常规脱水、浸蜡、包埋、切片,进行HE染色。制备好标本后, 利用图象分析软件分别观察其纤维化程度,三组对比。
1.2.3.3 免疫组化检测一抗为抗兔TGF-β1, 二抗为山羊抗兔IgG。采用SABC法(StreptAvidin - Biotin Complex.)显示组织和细胞中抗原分布。
1.2.4 统计学处理所有数据应用SPSS10.0统计软件处理, 结果以均数±标准差表示,采用单因素完全随机设计方差分析,多重比较行SNK-q检验, P < 0.05为有统计学意义。
2 结果 2.1 CT扫描表现a组影像学表现无明显变化。照射后1个月,b组5只接受CT检査的新西兰兔中有3只出现片状毛玻璃样改变,同期c组5只接受CT检查的新西兰兔中有2只出现片状毛玻璃样改变。照射后3个月,b组5只接受CT检查的新西兰兔中有4只出现照射野片状高密度影, c组5只接受CT检查的新西兰兔中有2只出现照射野片状高密度影,但范围均小于b组。照射后5个月,b组接受检査的5只新西兰兔全部出现照射野内大片的纤维化髙密度病灶,同期c组接受CT检查的5只新西兰兔表现为照射野散在的片状高密度影,范围及程度均小于同期的b组。
2.2 病理形态学改变 2.2.1 大体情况照射后1个月:a、b、c三组动物的肺组织,肉眼观察均为粉白色,未见出血及白色纤维化病灶。照射后3个月:a组动物双肺呈粉白色,未见出血及白色纤维化病灶。b组动物解剖后肉眼可见照射野呈暗红色,并有点状出血点; c组动物于照射野可见呈暗红色,也有少量点状出血点,均少于b组。照射后5个月:a组动物双肺均为粉白色,未见特殊病灶, b组动物于解剖后肉眼可见肺组织表明出现点片状白色病灶, c组动物的肺组织白色病灶比b组少。
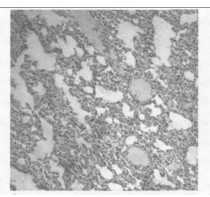
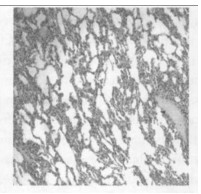
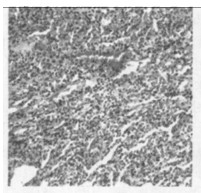
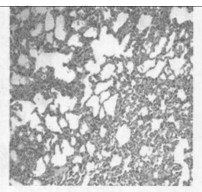
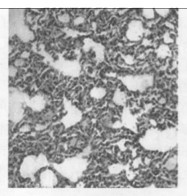
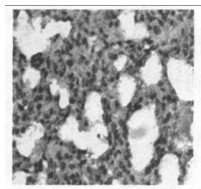
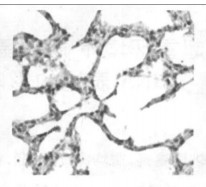
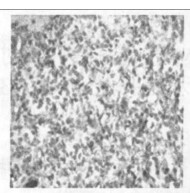
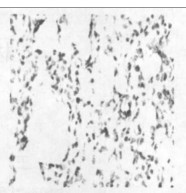
2.2.2 光镜所见照射1个月后肺组织表现为渗出、出血、水肿、肺泡上皮细胞脱落等急性炎症反应,三组中以b组病变最重。照射3个月后急性炎症表现消失,出现成纤维细胞的大量增生, 具体表现为间质细胞数增多、肺泡壁增厚、血管数减少。以b组最为明显。照射5个月时,肺组织纤维化明显,间质结构消失代之以纤维和胶原组织,肺泡腔狭窄,以b组最为明显。(图 1~7)

|
图 1 正常肺组织HE染色(×50) |
|
图 2 b组放疗后一个月肺组织的HE染色(×50) |
|
图 3 c组放疗后一个月肺肺组织的HE染色(×50) |
|
图 4 b组放射治疗3个月后肺组织的HE染色(×100) |
|
图 5 c组放射治疗3个月肺组织的HE染色(×100) |

|
图 6 b组放射治疗5个月后肺组织的HE染色(×100) |
|
图 7 c组放射治疗5个月后肺组织的HE染色 |
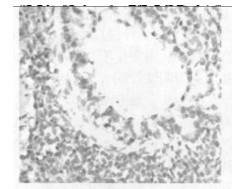
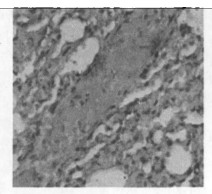
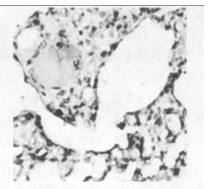
空白对照组,在其支气管上皮中TGF-β1呈不均一表达, 在肺实质中少量肺泡巨噬细胞呈阳性表达,而血管内皮和肌层均呈阴性。b组和c组新西兰兔, 照射后1个月、3个月、5个月均可见大量肺泡巨噬细胞和Ⅱ型肺泡细胞呈阳性表达,以第1个月明显; 还可见许多阳性纤维母细胞增生,以第5个月明显。见图(8 ~ 14)。
|
图 8 空白对照(a)组免疫组化图(×200) |
|
图 9 b组放射治疗一个月后免疫组化图(×200) |
|
图 10 c组放射治疗一个月后免疫组化图(×200) |
|
图 11 b组放射治疗3个月后免疫组化图(×200) |
|
图 12 c组放射治疗3个月后免疫组化图(×200) |
|
图 13 b组放射治疗5个月后免疫组化图(×200) |
|
图 14 c组放射治疗5个月后免疫组化图(×200) |
空白对照组阳性细胞数相对较低,仅波动在10~29个之间,中位数为14个。照射后1个月、3个月、5个月,单纯照射组的阳性细胞数较上述两组明显增高(P < 0.01),尤以1个月时最明显。照射+甲强龙组的细胞数则介于两者之间, 但仍然显著低于单纯照射组(P < 0.01),见图(8 ~ 14)。
3 讨论间质性肺疾病(interstitial lung disease, ILD)是一组主要累及肺间质、肺泡和(或)细支气管的肺部弥漫性疾病。它们具有一些共同的临床、呼吸病理生理学和胸部X射线特征。表现为渐进性劳力性气促、限制性通气功能障碍伴弥散功能(DLco)降低、低氧血症和影像学上的双肺弥漫性病变[3]。
放射性肺损伤是用放射的方法治疗胸部肿瘤时诱发的间质性肺疾病,包括早期的放射性肺炎和后期的放射性肺纤维化。病程多缓慢进展。逐渐丧失肺泡-毛细血管功能单位,最终发展为弥漫性肺纤维化和蜂窝肺, 发病时肺间质、肺泡、肺小血管或末梢气道都存在不同程度的炎症,早期临床表现多为刺激性咳嗽,胸闷、气短等,晚期在炎症损伤和修复过程中导致肺纤维化的形成。表现为呼吸困难甚至出现成人呼吸窘迫综合症(ARDS)[4]。严重时由于呼吸功能衰竭而死亡。
放射性肺炎通常发生在放射治疗后1 ~ 3个月。RTOG急性放射性肺炎的分级标准:Ⅰ级轻度的干咳或用力时呼吸困难;Ⅱ级持续性咳嗽,需要麻醉性镇咳药,轻微用力时呼吸困难;Ⅲ级严重咳嗽,麻醉性镇咳药无效,静时呼吸困难,临床及影像学有急性放射性肺炎的证据,间断吸氧或激素治疗; Ⅳ级呼吸功能不全,需持续吸氧或辅助通气[5-7]。
放射导致肺泡上皮细胞的损伤并使其分泌肿瘤坏死因子α(TNF - α)、转化生长因子β(TGF - β)和IL - 8等,包括这些因子在内的许多因子均参与肺组织损伤和随后的修复过程。其中转化生长因子β1 (TGF - β1)可能起了关键性作用[8]。
胸部影像学检查绝大多数ILD患者, X射线胸片显示双肺弥漫性阴影。阴影的性质可以是网格条索状、弥漫磨玻璃状、结节状,亦可呈现多发片状或大片状等, 可以混合存在。近年来采用高分辨CT, 能更细致地显示肺组织和间质形态的结构变化和大体分布特点,成为诊断ILD的重要手段之一。
放射性肺损伤的病理改变为肺充血、水肿、肺间质增厚及肺泡腔萎陷变小[9]。放射性肺损伤分为放射性肺炎和放射性肺纤维化两个阶段,而放射性肺纤维化的发生,往往是不可逆的[1]。因此, 预防放射性肺炎就成为预防放射性肺损伤的重要途径。某些以炎症改变为主的ILD, 如果能够在早期炎症阶段去除致病因素或得到有效的治疗,其病变可以逆转; 如果炎症持续, 将导致肺结构破坏和纤维组织增生,最终形成不可逆的肺纤维化和蜂窝肺的改变。一般肺组织受照射20Gy后就会产生永久性放射性损伤, 受照射30 ~40Gy可产生急性渗出性炎症。多年来, 大量的动物实验和临床研究使人们对放射性肺损伤的发病机制及临床表现有了近一步了解,同时也加深了人们对放射性肺损伤药物干预的认识。但对于放射性肺损伤的预防,目前尚无真正有效的措施。寻求有效防治放射性肺损伤的药物是国内外研究的热点。
关于防治放射性肺损伤的研究主要有活性氧清除剂、巯基化合物、一氧化氮(NO)、硒制剂、中医药和激素。研究表明[2]:糖皮质激素的作用为①可直接抑制与炎症反应有关的许多细胞因子的转录,包括IL-8、肿瘤坏死因子(TNF-a)等。②可作用于不同的炎症细胞和介质,减轻炎症反应。③还可抑制气道内内皮素-1和增加分泌性白细胞蛋白酶阻滞物(SLPI)的合成,减轻支气管收缩和气道炎症反应。④可增强β2肾上腺素能受体的基因转录和抑制TNF - β的活化阻断细胞间粘附分子-1 (ICAM-1)和E-选择素的表达,减轻气道和肺实质的炎症反应。
甲强龙(甲泼尼龙琥珀酸钠,美国辉瑞投资有限公司生产)是人工合成中效糖皮质激素,抗炎作用为氢化可的松的7倍, 特别是与呼吸系统糖皮质激素受体亲和力强,水盐代谢作用较氢化可的松弱,对下丘脑-垂体-肾上腺(HPA)轴的抑制时间较地塞米松短,激素的毒副作用明显减少。相等剂量时,甲泼尼龙琥珀酸钠(甲强龙)在肺组织和肺泡上皮衬液中的浓度较强的松高,且滞留时间也较长,所以我们认为在防治肺组织纤维化中是治疗的首选药物。
本实验旨在探讨低剂量甲强龙对放射性肺损伤的防治作用。结果说明甲强龙对照射后TGF-β1高表达有一定抑制的作用,可以降低照射部位组织中TGF-β1的含量,从而减轻放射性肺损伤的发生率和程度。本实验提示甲强龙可能抑制TGF-β1的表达,同时具有抗炎和免疫抑制效应,从而明显抑制早期渗出性病变, 减少促纤维化细胞因子产生,最终减轻放射性肺损伤的发生,值得近一步研究。糖皮质激素应该在纤维化早期的肺泡炎阶段运用。
| [1] |
傅尚志, 张楚毅. 放射性肺炎研究进展[J]. 中国癌症杂志, 1999, 9(1): 56. |
| [2] |
张旻. 糖皮质激素在急性呼吸窘迫征的应用进展[J]. 临床肺科杂志, 2002, 5(7): 36-38. |
| [3] |
钟南山.间质性肺疾病与结节病.[M]见: 叶任高, 陆再英, 主编.内科学.6版.北京: 人民卫生出版社, 2004: 92-94.
|
| [4] |
Tang ZY. Modern oncology[M]. 2nd ed. Shanghai: The Publishing Company of Shanghai Medical College, 2000: 887-889.
|
| [5] |
Vujaskovic Z, Anscher MS, Feng QF, et al. Radiation-induced hypoxia may perpetuate late normal tissue injury[J]. Int J Radiat Oncol boilphys, 2001, 50: 851-855. DOI:10.1016/S0360-3016(01)01593-0 |
| [6] |
Pauluhn J, Baumamm M, Hirth-Dietrich C, et al. Rat model of fibrosis:comparison of functional, biochemical, and histopathological changes 4 months after single irradiation of the right hemithorax[J]. Taxicology, 2001, 161: 153-163. DOI:10.1016/S0300-483X(00)00413-3 |
| [7] |
Marks LB, Yu X, Vugaskovic I, et al. Radiation-induced lung injury[J]. Semin Radiat Oncol, 2003, 13: 333-345. DOI:10.1016/S1053-4296(03)00034-1 |
| [8] |
Rube CE, Uthe D, Schmid KW, et al. Dose dependentinduction of transforming growth factor beta (TGF2beta) in the lung tissue of fibrosis-prone mice after thoracic irradiation[J]. Int J Radiat Oncol Biol Phys, 2000, 47(4): 1 033-1 042. DOI:10.1016/S0360-3016(00)00482-X |
| [9] |
曹珍山, 叶常青, 袁丽珍, 等. 大鼠胸部受到20CyX线胸放射后肺组织形态剂量学改变[J]. 中华放射医学与肪护杂志, 1996, 16(3): 167-169. |



