动物模型是各种癌症诊疗研究的重要材料之一, 建立简单易行、成模时间短、成模率高、重复性好及肿瘤细胞生物特性较稳定的模型非常必要。免疫系统在肿瘤发生发展中占据重要地位, 本实验通过研究不同品系小鼠, 建立Lewis肺癌肿瘤模型, 比较其生物学、免疫学特性, 为进一步开展肺癌的免疫研究提供更好的动物模型。
1 材料和方法 1.1 材料 1.1.1 动物及瘤株IRM-2小鼠是我所培育的近交系小鼠, C57BL/6小鼠由本所动物室提供, 体重为22 ~ 23g, 雄性, 每组15只, 饲料为清洁级全价鼠料, 由北京科奥协力饲料有限公司提供, Lewis肺癌瘤株购自中国医学科学院药物研究所。
1.1.2 试剂及仪器RPMI1640培养基为美国Gibco公司产品。显微镜, Coulter Altra流式细胞仪(美国Beckman), 离心机(美国Beckman)。
1.2 方法 1.2.1 肿瘤接种无菌解剖荷瘤小鼠, 取肿瘤组织, 剪碎, 加生理盐水放入匀浆器研磨(细胞数约为2 ×106 /ml), 取细胞悬液0.2ml/只注入皮下, 建立荷瘤鼠模型。
1.2.2 荷瘤鼠体重曲线隔日称重, 绘制体重变化曲线。
1.2.3 外周血分类眼静脉丛取血, 涂片, 常规法进行细胞分类。处死小鼠取胸腺和脾脏, 称重, 计算胸腺指数、脾脏指数和净增体重。观察IRM-2和C57BL/6荷瘤鼠生存时间。
1.2.4 流式检测样品制备每只小鼠取外周血50μl×3管, 加入1ml红细胞裂解液。剧烈振荡后避光孵育15min, 800r/ min离心5min, 用PBS洗涤两次。加入相应抗体, 避光孵育15min, 进行流式检测。
1.3 统计学处理实验数据以x±SD表示, 组间比较采用t检验。
2 结果 2.1 两品系小鼠的成瘤率IRM-2、C57BL/6小鼠Lewis肺癌成瘤率均为100%, IRM-2小鼠于接种后第7天成瘤率达100%, C57BL/6小鼠于第9天达100%, 差异无统计学意义, 均无自然消退现象。
2.2 两品系荷瘤小鼠体重变化(图 1)
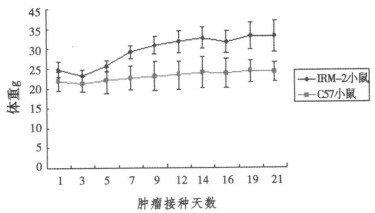
|
图 1 荷瘤小鼠体重变化曲线 |
IRM-2荷瘤小鼠与C57BL/6荷瘤小鼠比较体重增加较明显, C57BL/6小鼠呈明显的消瘦体征。
2.3 两品系荷瘤小鼠生存期(图 2)
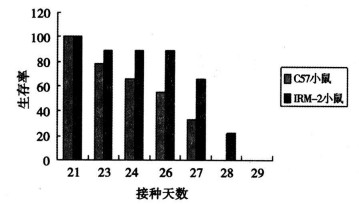
|
图 2 荷瘤鼠生存时间 |
IRM-2荷瘤小鼠的平均生存时间为25.5d, C57BL/6荷瘤小鼠为24.5d。
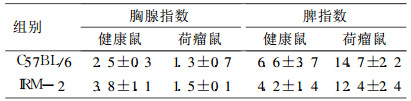
2.4 两品系荷瘤鼠脏器指数(表 1)|
|
表 1 IRM-2、C57BL/6荷瘤小鼠脏器指数结果 |
IRM-2小鼠胸腺指数高于C57BL/6小鼠。
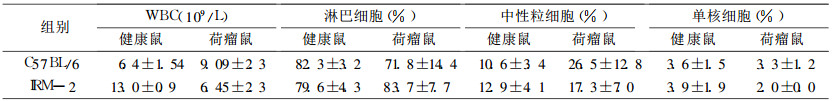
2.5 两品系荷瘤小鼠外周血白细胞分类(表 2)|
|
表 2 IRM-2、C57BL/6小鼠及荷瘤鼠外周血白细胞分类 |
IRM-2小鼠白细胞总数高于C57BL/6小鼠, 但荷瘤鼠的白细胞总数低于C57BL/6小鼠。
2.6 两品系荷瘤小鼠CD4、CD8表达量(表 3)|
|
表 3 IRM-2、C57BL/6小鼠及荷瘤鼠CD4、CD8表达量 |
IRM-2小鼠、IRM-2荷瘤鼠CD4/CD8比值均低于C57BL/6小鼠及C57BL/6荷瘤小鼠。
3 讨论一个好的动物模型, 对于人类各种疾病的发生、发展机制的研究和治疗效果的评价均起着重要作用。因此, 选择并建立理想的肿瘤模型, 对于抗癌药的深入研究具有重要意义。IRM -2小鼠是本所自主培育的近交系小鼠[1], 该小鼠对多种肿瘤易感[2]。本课题对IRM-2小鼠与Lewis肺癌原发C57BL/6小鼠的肿瘤模型的生物学特性进行对比研究, 在建模方法及基本特征等方面来证明该肿瘤模型的合理性和科学性。实验结果表明, IRM -2小鼠、C57BL/6小鼠Lewis肺癌成瘤率均为100%, IRM-2小鼠于接种后第7天成瘤率达到100%, 其成瘤率早于C57BL/6小鼠, C57BL/6小鼠于第9天成瘤率达到100%。IRM-2荷瘤小鼠的平均生存时间为25.5d, C57BL/6荷瘤小鼠为24.5d, 但差异没有统计学意义
CD4、CD8均是T细胞重要的表面标志。T淋巴细胞及CD4和CD8细胞数量及比值的变化直接反应机体的免疫应答水平。在诊断和治疗某些重症疾病时, 采用检测CD4和CD8以及其比值变化, 对确定动物体的免疫能力及疾病状态都具有重要意义。当CD4和CD8比值增大时, 表明机体具有较强的免疫功能, 从结果可以看出, IRM-2小鼠及荷瘤鼠的CD4/ CD8比值低于C57BL/6小鼠及C57BL/6荷瘤鼠, 该小鼠对多种肿瘤易感可能与之有关。
CD11b是整合素β2亚家族成员之一, 近年来发现CD11b等在介导炎症、血栓形成过程中发挥重要作用[3-6]。本研究表明CDllb在两品系小鼠中的表达不同, IRM-2健康鼠的CDllb比C57BL/6健康鼠要高表达。有关IRM-2小鼠的免疫学指标有待进一步深入探讨, 使之具有广泛的应用价值。
| [1] |
王月英, 周继文, 王汝勤. IRM-2近交系小鼠的生殖生长特性[J]. 中国实验动物学报, 2001, 9: 103-106. DOI:10.3969/j.issn.1005-4847.2001.02.008 |
| [2] |
王月英, 周继文, 穆传杰. IRM-2近交系小鼠肿瘤模型的建立[J]. 中国比较医学杂志, 2003, 13(4): 246-248. DOI:10.3969/j.issn.1671-7856.2003.04.016 |
| [3] |
Panasiuk A, Zak J, Kasprzycka E, et al. Blood platelet and Monocyte activations and relation to stages of liver cirrhosis[J]. World J Gastroenterol, 2005, 11(18): 2754. DOI:10.3748/wjg.v11.i18.2754 |
| [4] |
Telejko B, Zak J, Bachorzewska-Gajewska H, et al. Platelet Monocyte aggregate formation in patients with coronary heart disease and Disease and disorders of carbohydrate merabolism[J]. Pol Arch Med Wewn, 2004, 112(3): 1067. |
| [5] |
Graf M, Reif S, Kroll T, et al. Expressionof MAC-1 (CD11b) in acute myeloid Leukemia (AML) is associared with an unfavorable prognosis[J]. Am J Hematol, 2006, 81(4): 227. DOI:10.1002/(ISSN)1096-8652 |
| [6] |
Matos D M, Rizzatti E G, Garcia A B, et al. Adhesion molecule profiles of B-cell non-Hodgkin's lymphomas in the leukemic phase[J]. Braz J Med Biol Res, 2006, 39(10): 1349. DOI:10.1590/S0100-879X2006001000011 |