近年来, 随着世界核安全形势的紧张以及放射治疗的迅速发展, 尤其是核电站、辐射加工工艺等的出现, 核辐射事故的发生呈现增加趋势, 同时造成了严重的环境放射性污染, 人员伤亡和经济损失, 因此对于辐射防护药物的研究再一次引起人们的关注。目前, 临床上用于预防和治疗放射性皮肤损伤的药物较多, 包括含硫化合物、激素类、细胞因子类、中草药等。笔者对近年来国内外辐射防护药的研究进展及应用作一综述, 旨在为寻求高效低毒的辐射防护药物奠定基础。
1 含硫化合物目前, 研究最广泛和较深入的是含硫类化合物, 如半胱胺、胱胺、AET和氨磷汀(WR-2721)等, 尽管含硫化合物存在着不少缺点, 人们仍然认为它是最有效的抗辐射类型之一。国外对含硫化合物的研究比较透彻, 陆续合成了多种半胱胺衍生物, 但毒性较大, 有效作用时间较短。为了降低毒性, 延长作用时间, 化学家们对半胱胺进行了结构改造。氨乙基异硫脲(AET)就是半胱胺的巯基被脒基取代的衍生物。AET防护作用时间较半胱胺长, 且能口服, 预防效果较好。缺点是无论口服或注射给药副作用均较大。随后国外学者又合成了一系列氨基上取代半胱胺的磷酸酯衍生物, 其中以WR-2721(氨磷汀)为代表, 是目前公认的防护效果最好的化合物。它是国际管理机构通过的第一个有选择性的广谱细胞保护剂。WR- 2721的预防给药可使正常组织避免烷化剂、有机铂等化疗药物引起的细胞毒, 同时WR-2721对骨髓祖细胞具有保护作用。目前氨磷汀多用于临床放化疗的肿瘤患者, 对头颈部、盆腔和咽喉部肿瘤患者的辐射防护作用研究已进入临床试验阶段[1]。最近, Grdina DJ等[2]发现, 在小剂量低毒性水平照射前服用氨磷汀, 具有非常有效的阻止诱变和癌症发生的效果, 建议放弃将该药大剂量用于防护组织细胞损伤的目的, 而放在小剂量低毒性水平用于抗诱变、抗癌变。但由于氨磷汀发挥疗效时所需剂量接近于出现毒性的剂量; 可以引起低血压、恶心、呕吐等副作用且半衰期短、价格昂贵; 使其在临床上的使用受到限制。迄今为止尚未找到一种十分理想的抗辐射化合物用于人体, 需要继续寻找一种高效、低毒的新型抗辐射药物。
2 激素类我国对激素类抗辐射药物的研究较多, 且研究比较深入; 在这方面取得了较大的成就, 也发现了很多这方面的抗辐射药物并应用于临床。天然甾体激素(如雌二醇)或人工合成的非甾体激素(如已烷雌酚、已烯雌酚等)在动物实验中都显示一定程度的辐射防护作用, 而且辐照前后给药都有效果。研究证明, 雌激素类药物对急性放射病具有良好的防治作用, 炔雌醇是其中的一种, 它对实验性急性放射病有良好的防治效果, 但该药具有副作用较强的特点。E838是对炔雌醇进行系统改造后人工合成的一种新的衍生物, 其目的是为了提高疗效, 减少副作用。Vijayalaxnd等[3]对松果腺分泌物褪黑激素(N-乙酰-5-甲氧基色胺)的辐射防护作用做了大量的研究, 小鼠在LD50/30d的急剧全身照射剂量下给予褪黑激素剂量在250mg/ kg下, 存活率可达85%而未产生毒性。
激素类对辐射损伤的防治主要是对骨髓有核细胞、造血干细胞和祖细胞都有明显的辐射防护作用, 并能促进它们的恢复。但是激素类对性器官的影响, 随给药剂量及给药次数的增加而增大, 长期多次使用, 可引起暂时性的乳房胀痛、硬结; 女性可引起月经失调; 男性引起睾丸萎缩, 生精细胞抑制副作用, 因此其临床上的广泛应用受到了限制。
3 细胞因子骨髓造血功能抑制是辐射损伤(ARI)最主要的病理损伤, 而且贯穿于放射损伤的始终, 是患者死亡的主要原因。因此减轻造血功能的损伤和促进造血功能的恢复是放射损伤治疗的关键。研究发现.即使动物受致死剂量照射仍有存活的造血干细胞.这些存活的干细胞在造血细胞生长因子的刺激下仍能增殖、分化和成熟, 造血刺激因子的应用是辐射损伤治疗中不可缺少的一个重要环节。近年来, 发现许多细胞因子在放疗和化疗后具有促进骨髓重建的作用, 如IL-3(白介素-3)、IL-6、IL-ll、G-CSF、M-CSF、EPO、Thrombopoietin(Tpo)和SCF能够促进造血细胞的增殖和分化。IL-1、TNF-α、SCF、IL-12和bFGF照射前给药对致死剂量照射的动物具有辐射防护作用, 而G-CSF和GM-CSF照射后给药具有防护作用。
3.1 IL-1IL-1是第一个被证明具有辐射防护作用的细胞因子, 一定剂量的IL-1可通过清除自由基而降低内外因素引起的损伤。同时IL-1是多种细胞产生的具有多种生物活性的细胞因子, 主要由单核巨噬细胞产生, 生理功能非常广泛, 它可诱导单核巨噬细胞分泌TNF、IL-1, 间接诱导T淋巴细胞产生IFN-γ, 以及促进NK细胞活性等, 因此, IL-1其潜在的临床意义在于增强免疫功能、造血功能。如果IL-1预先注射可以改善受辐射动物的骨髓细胞损伤和内源性脾集落的形成, 其辐射防护作用与给药时间密切相关[4], 但其致炎症作用限制了其临床应用。
3.2 CSFs人们早就发现辐射前或辐射后单独使用G-CSF、M-CSF或GM-CSF均无显著的辐射防护作用, 但它们分别与IL-1联合应用均具有较好的抗辐射作用。FARESE等报道PEG-rHuMGDF与G-SCF联合给药可以显著改善血小板的恢复, 改善嗜中性粒细胞的恢复PEG-rHuMGDF能够降低血小板减少症的严重程度。缩短血小板减少症的发病周期[5]。G -CSF和GM-CSF均为小分子造血生长因子, 可刺激早期具有多向潜能的造血祖细胞增殖和分化, 在临床上广泛运用于中性粒细胞减少症。研究表明, G-CSF可明显促进6.5Gyγ射线不均匀照射的狗的骨髓有核细胞及骨髓CFU-GM增殖, 加速外周血白细胞、网织红细胞和血小板数的恢复, 缩短中性粒细胞和血小板最低值的持续时间。
3.3 TNFTNF家族含有个成员:TNF-α、TNF-β、淋巴毒素β和LIGHT。TNF-α主要来源于单核细胞, 具有类似IL-1的辐射防护作用, 许多研究结果表明, TNF-α预防给药对小鼠具有很好的抗辐射作用。TNF-α的抗辐射作用可被抗IL-1R抗体中和。TFN-α通过诱导炎症介质、促进血栓形成、刺激成纤维细胞生长, Rubea等[6]发现, 照射前一周内在饮用水中加入500mg/L已酮可可碱(PTX)可抑制12Gyβ射线照射小鼠胸部引起的支气管上皮细胞、血管内皮细胞、血管平滑肌细胞TNF-α的表达和炎症反应的发生, 其抗纤维化主要机制可能是抑制PDGF介导的成纤维细胞的增生。
近年来, 由于细胞因子在升高患者白细胞、促进造血和免疫功能重建中显示出的独特作用, 并在辐射损伤临床救治中取得了令人瞩目的成就, 迅速成为当今抗辐射药物的研究热点。尽管如此, 细胞因子是否适合在核事故中大规模应用仍值得怀疑。原因除了价格昂贵, 难以常温保存外, 还有药物普遍具有严重的副作用。细胞因子之间的配伍、细胞因子与其他辐射防护药物的配伍使用、高效抗辐射细胞因子的结构改造等是今后放射防护研究领域的主要方向之一, 因此对细胞因子还需要更加深入的研究, 为临床应用提供更好的抗辐射药物。
4 中草药由于中草药药源广, 毒性低, 用中草药防治因电离辐射造成的机体损伤已经开始引起人们的普遍关注。经多年的研究表明具有清热解毒、活血化瘀、补血益气、养阴升白的中草药均有不同程度的抗辐射作用。中草药抗辐射作用的机制主要为提高生存率、清除自由基、保护DNA、保护免疫系统、保护造血系统及对细胞因子的诱导和调节等。
4.1 单味中草药的辐射防护作用放射损伤后各种血细胞均有不同程度的变化其中淋巴细胞是最敏感的细胞, 补益药大都能增强人体的免疫功能, 因此, 补益药在治疗放射损伤的中草药中占重要的地位。研究表明, 人参、灵芝等单味补益药具有较好的抗辐射效果。人参能提高放疗后小鼠空肠隐窝细胞的存活率, 增加内源性脾克隆形成率, 减少细胞凋亡。人参中的脂溶性酸性物质、游离糖和皂甙类可能发挥了主要的辐射防护作用。Kumar等[7]研究了人参根提取物对受照小鼠的磷酸酶和脂质过氧化水平的影响、结果显示, 单独给药对正常小鼠的磷酸酶和LPO水平无明显影响。放射加药组与单纯照射组相比, 酸性磷酸酶和LPO水平明显降低、碱性磷酸酶活性增加, 且与单纯照射组有显著性差异。通过研究表明, 从Swertiacalycinabranch垒草中提纯的氧氮卓酮类, 多次注射可显著提高CFU-S及BMC对hnGM-CSF的再生性反应, 一次注射可显著增加外周血白细胞和血清中集落刺激因子(CSF)的数目, CS的种类为M-CSF和其他的造血因子[8]。
4.2 中草药复方制剂对辐射损伤的防护作用中药复方如地甘口服液由熟地黄、炙甘草为主组成。地甘口服液可通过促进干、祖细胞和基质细胞集落的形成来达到保护造血系统, 抗辐射损伤的目的, 进一步研究表明, 地甘口服液不仅能增强造血干细胞粘附分子的表达, 而且还能促进基质细胞粘附分子的表达, 通过骨髓细胞周期素基因cylinD1的转录水平, 使造血细胞不断分化成熟和向外周循环输送, 起到补血的作用[9]。
4.3 中药不同组分辐射防护作用 4.3.1 多糖类对辐射损伤的防护作用多糖为一大类天然产物, 具有能量储存、结构支持, 防御和抗原决定性等多方面的生物功能。研究发现多种多糖(红景天多糖、黄蘑多糖、木耳多糖、海藻多糖等)具有明显的抗辐射作用。其机制可能与抗免疫损伤、保护造血系统、清除自由基等有关。①多糖能促进造血细胞的增殖与分化, 对骨髓有核细胞与CFU-S产生一定的影响, 对GM-CFU的数量有增多作用, 从而使外周血白细胞数升高。②多糖能通过对体液免疫、细胞免疫、单核巨噬细胞、细胞调节因子的调节, 增加机体的免疫功能。詹林盛等[10]小鼠腹腔注射海带多糖后, 发现每天注射100mg/kg连续10d能显著提高小鼠胸腺、脾指数及外周血白细胞数, 促进T, B淋巴细胞增殖, 产生抗体和迟发性变态反应的能力, 激活腹腔巨噬细胞。③多糖能使辐射所引起的迟发型超敏感性反应低下和SOD活性下降明显恢复, 过氧化水平降低, 清除自由基等发挥辐射防护作用黄蘑多糖可促进自由基清除, 抑制或者阻断自由基引发的脂质过氧化反应, 可明显增强受X线照射小鼠的免疫功能[11]。
4.3.2 酚类对辐射损伤的防护作用酚类物质的多元酚羟基均具有与氧自由基反应的作用, 截断自由基的链式反应, 从而具有良好的捕集自由基的功效。杨梅多酚是从杨梅的根皮中提取的一类多元酚成分。迟文等[12]通过建立辐射损伤动物模型, 观察杨梅多酚对辐射损伤的血细胞和造血组织的保护作用。实验结果显示, 杨梅多酚能提高受照小鼠外周血有形细胞数、骨髓有核细胞数及核分裂指数, 并能保护血液的止血功能。知母宁、槲皮素等天然黄酮类在较低浓度(0.5mg/m1)就能达到50%以上的自由基清除率。
虽然中草药结构复杂, 很难搞清其防治机理, 但是随着中药现代化进程的不断向前发展, 中草药在防治辐射损伤方面的研究也更加深入, 其应用也会更加广泛和合理。同时中药具有活性成分多, 抗辐射效果显著, 无毒或低毒等特点, 其作为研究与开发抗辐射的药物具有广阔的前景。
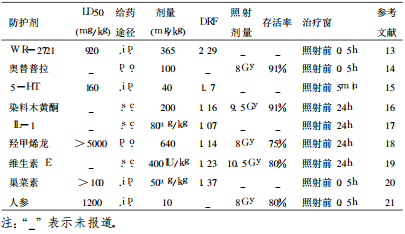
5 各类辐射防护剂比较为了预防和减轻核辐射事故对人体健康的危害, 研究辐射损伤防治手段, 积极寻找有效抗辐射损伤药物已成为一个迫切需要解决的问题。面对这种现象, 各种化学药物、天然药物以及生物制剂应运而生。由于大剂量电离辐射诱导的生物效应和后果与低水平电离辐射诱导的生物效应和后果大为不同, 在大剂量照射情况下表现出防护效果的防护剂不一定能用于小剂量辐射损伤的防护。通过对各类辐射防护剂的比较, 来分析近年来各类辐射药物的研究情况, 结果见表 1
|
|
表 1 辐射防护剂特性的比较 |
经过近半个世纪的努力, 抗辐射损伤药物研究已取得瞩目的成绩; 但总的来说, 仍存在许多的问题, 如:放射防护剂对肿瘤组织的作用如何, 目前研究较少, 临床最佳用药时机, 用药剂量, 辐射防护剂作用的有效部位, 作用靶点, 作用机理等; 由于药物防护效价低、有效时间短、毒性不良反应大等, 使用受到限制。随着相关研究的不断深入, 寻找高效低毒的新型抗辐射药物具有重要的意义。同时国外对辐射防护药物除了深入研究含硫化合物外, 细胞生长因子、免疫和生物生化制剂等占有重要位置。相对来说国内对细胞因子、中草药及雌激素的抗辐射作用的研究较多。目前极具潜力的辐射防护药物主要有乙酰半胱氨酸的同分异构体、金雀异黄素、维生素E、细胞防护药物、雌激素类、中草药类等。这些抗辐射药物具有疗效显著、低毒等优点, 是一些具有很大潜力的抗辐射药物。并相信随着研究的进一步深入, 越来越多的高效低毒、防治兼备的辐射防护药物将应用于临床。
| [1] |
Anne PR. Phase Ⅱ trial of subcutaneous amifetine in patients undergoing radiation therapy for head and neck cancer[J]. Semin Oncol, 2002, 29(Suppl 19): 80-83. |
| [2] |
Grdina DJ, Murly JS, Kataoka Y, et al. Relationships between cytoprotection and mutation prevention by WR-1065[J]. Mil Med, 2002, 167(suppl 1): 51-53. |
| [3] |
Vijayalami, Meltz MT, Renler RJ, et al. Melatonin and protection from whole-body irradiation:survival studies in mice[J]. MutalRes, 1999, 425: 21-27. |
| [4] |
Singh VK, Srinivasan V, Seed TM, et al. Radioprotection by N-palmitoylated nonapoptide of human interleukin-1β[J]. Peptides, 2005, 26(3): 413-418. DOI:10.1016/j.peptides.2004.10.022 |
| [5] |
Farese AM, Macvittie TJ, Roskos L, et al. Hematopoietic recovery following autologons bone marrow transplantation in a non-human primate:effect of variation in treatment schedule with PEG-rHuMGDF[J]. Stem Cells, 2003, 21: 79-89. DOI:10.1634/stemcells.21-1-79 |
| [6] |
Rubea CE, Wilferta F, Danielab U, et al. Melatonin ameliorates ionizing radiation-induced oxidative organ damage in rats[J]. Life sciences, 2003, 74: 563-572. DOI:10.1016/j.lfs.2003.05.011 |
| [7] |
Kumar M, Sharma MK, Saxena PS, et al. Radioprotective Effect of Panax ginseng on the Phosphatases and Lipid Peroxidation Level in Testes of Swiss Albino Mice[J]. Biol.Pharm.Bull, 2003, 26(3): 308-312. DOI:10.1248/bpb.26.308 |
| [8] |
Ya BQ, Nian LC, Li C, et al. Protective effect of swerebron on hematopoiesis in 60Co irradiated mice[J]. Phytomeicine, 1999, 6: 85-88. DOI:10.1016/S0944-7113(99)80040-3 |
| [9] |
何东初, 何辉, 吴江平, 等. 中药复方对辐射损伤小鼠骨髓细胞周期素基因及粘附分子表达的作用[J]. 中国中医药信息杂志, 2004, 11(11): 980-981. DOI:10.3969/j.issn.1005-5304.2004.11.019 |
| [10] |
詹林盛, 张新生, 吴晓红. 海带多糖的免疫调节作用[J]. 中国生化药物杂志, 2001, 223(4): 116-118. |
| [11] |
姜世权, 叶飞, 苏士杰, 等. 黄蘑多糖的辐射防护作用及其机理的初步探讨[J]. 中国辐射卫生, 2001, 10(2): 67. DOI:10.3969/j.issn.1004-714X.2001.02.002 |
| [12] |
迟文, 徐静, 郭凌燕, 等. 杨梅多酚对核辐射损伤的血细胞与造血组织的保护作用[J]. 解放军药学学报, 2003, 19(3): 168-170. DOI:10.3969/j.issn.1008-9926.2003.03.003 |
| [13] |
Brown DQ, Shaw LM, Pittock JW, et al. Early results of the screening program for radioprotcctora[J]. Int.J.Radiat.Oncol.Biol.Phys, 1982, 85: 65-570. |
| [14] |
Otieno MA, Kensler TW, Guyton KZ. Chemoprotective 3H-1, 2-dithiole-3-thione induces antioxidant genes in vivo[J]. Free Radic.Biol.Med., 2000, 28: 944-952. DOI:10.1016/S0891-5849(00)00175-1 |
| [15] |
Maisin JR, Albert C, Henry A. Reduction of short-term radiation lethality by biological response modi? ers given alone or in associa-tion with other chemical protector[J]. Radiat.Res., 1993, 135: 332-337. DOI:10.2307/3578872 |
| [16] |
Streeter PR, Dudley LZ, Fleming WH. Activation of the G-CSF and Flt-3 receptors protects hematopoietic stem cells from lethal irradiation[J]. Exp.Hematol, 2003, 31: 1119-1125. DOI:10.1016/S0301-472X(03)00257-1 |
| [17] |
Hosseinimehr SJ, Zakaryaee V, Froughizadeh M. Oral oxymetholone reduces mortality induced by gamma irradiation in mice through stimulation of hematopoietic cells[J]. Mol. Cell.Biochem, 2006, 287: 193-199. DOI:10.1007/s11010-005-9111-5 |
| [18] |
Kumar S, Sarr MG, Kamath PS. Nutritional approaches to radiation protection[J]. Mil.Me, 2002, 167: 57-59. DOI:10.1093/milmed/167.suppl_1.57 |
| [19] |
Uma Devi P, Ganasoundari A, Rao BS, et al. In vivo radioprotection by ocimum flavonoids: survival of mice[J]. Radiat. Res, 1999, 151: 74-78. DOI:10.2307/3579750 |
| [20] |
Pande S, Kumar M, Kumar A. Evaluation of radiomodifying effects of root extract of panax ginseng[J]. Phytother.Res., 1998, 12: 13-17. DOI:10.1002/(ISSN)1099-1573 |




 ,
,