2. 中国医学科学院放射医学研究所, 天津市分子核医学重点实验室
目前, 放射治疗仍然是肿瘤治疗的重要手段之一, 但在不同个体相同器官且相同病理类型的肿瘤往往表现出不同的辐射敏感性[1], 所以, 对肿瘤细胞辐射敏感性的评价在临床上显得非常重要。对原代肿瘤细胞辐射敏感性的预测可以为不同患者个体提供最优化的治疗方案[2]。虽然许多实验室以检测生物标志来预测肿瘤的辐射敏感性, 但尚缺乏特异性。近年来, 国外有学者开始研究线粒体DNA (mitochondrialDNA, mtDNA)缺失的直接检测作为新的辐射生物学终点[3, 4], 以期获得快速预测肿瘤细胞辐射敏感性的方法。mtDNA是惟一的核外遗传物质, 每个细胞中约有100~1 000个mtDNA分子。它位于线粒体的内膜, 容易遭受到活性氧自由基侵害, 同时缺乏有效的修复系统及组蛋白保护, 其突变率远远高于核DNA, 为核DNA的10~20倍[5]。在各类突变中, mtDNA的缺失突变成为生物医学领域的研究热点。
本研究采用三种肿瘤细胞株:肝癌细胞(HepG2)、食管癌细胞(EC-9706)和乳腺癌细胞(MCF-7)为研究对象, 用MTT (Methyl Thiazolyl Tetrazolium)比色法和巢式PCR法探讨多种生物学指标结合(MTT和mtDNA4977bp缺失)用于肿瘤细胞辐射敏感性检测的可行性。
1 材料和方法 1.1 肿瘤细胞系肝癌细胞(HepG2)、食管癌细胞(EC- 9706)和乳腺癌细胞(MCF-7)均为中国医科院放射医学研究所实验室保存。
1.2 主要试剂和仪器RPMI1640培养基为Gibco公司产品, 线粒体DNA提取试剂盒为上海杰美基因医药科技公司产品, TaqDNA聚合酶为上海捷瑞生物工程公司产品, MTT为Amressco公司产品, 分析纯DMSO (二甲基亚砜)为上海生工生物工程公司产品。低温超速离心机为日本Hitachi公司产品, MK3酶标仪和PCR仪为美国Thermo公司产品, 凝胶图像处理系统为美国Bio-Rad公司产品。水平电泳仪为BIO-RAD公司产品。
1.3 MTT比色实验用RPMI1640培养基制成单细胞悬液, 调整细胞密度为1 ×105个/ml, 分装后进行137Csγ射线照射, 剂量点为0、1、2、4和8Gy, 剂量率为1.23Gy/min。将照射与未照射的细胞分别接种于96孔培养板中, 每孔均接种200μl, 每个剂量组设6个复孔, 在37℃含5% CO2饱和湿度的培养箱中培养。3d后于终止培养前4h, 每孔加入5mg/mlMTT 20μl, 孵育完毕后小心吸除孔内液体, 每孔加150μlDMSO, 微型振荡器振荡10min, 用酶标仪在492nm波长下测定各孔光吸收值(A), 计数细胞存活分数(SF)=照射组A值/对照组A值。
1.4 巢式PCR扩增 1.4.1 引物设计调整细胞数量为5 ×107个/ml, 进行137Csγ射线照射, 剂量点为0Gy、1Gy、4Gy和8Gy, 剂量率为1.23Gy/ min。照射后的细胞在37℃培养箱中孵育2h, 然后按试剂盒说明书操作提取mtDNA。表 1列出了用于扩增缺失的引物对[3]。P1-P2引物对可扩增出代表总mtDNA的533bp片段, 以此作为内参计算mtDNA4977bp缺失的比例。用P3-P4引物进行第1轮扩增, 将其扩增产物进行P5-P6为引物的第2轮扩增, 将P5-P6引物扩增的产物进行P7-P8为引物的第3轮扩增。P3-P4引物对在最外侧, P7-P8引物对在最内侧。所有引物由上海捷瑞生物工程公司合成。
|
|
表 1 巢式PCR扩增mtDNA的引物 |
以P1-P2为引物的反应条件为第1个循环94℃变性5min, 55℃退火5min, 72℃延伸3min。第2~35个循环为94℃变性40s, 55℃退火40s, 72℃延伸50s。本实验在mtDNA4977bp缺失片段的两侧设计了3对引物, 通过限制PCR反应条件, 未缺失的mtDNA不会产生PCR产物。因为对于正常的mtDNA, 因较短的延伸时间不足以合成大于5kb的片段, PCR将无片段产生, 而只有4977bp缺失的mtDNA才会产生PCR产物。以P3-P4为引物的反应条件为94℃预变性3min, 94℃变性1min, 45℃退火1min, 72℃延伸1min, 共35个循环, 最后72℃延伸10min。以P5-P6、P7-P8为引物的反应条件为94℃预变性3min, 94℃变性40s, 45℃退火40s, 72℃延伸40s, 共35个循环, 最后72℃延伸10min。
1.4.3 mtDNA4977缺失定量分析扩增产物在1%琼脂糖凝胶(含0.5μg/ml的EB)中电泳, 用Doc1000凝胶成像系统采集图像, 用MolecularAnalysisTM软件分析电泳条带的灰度值, 以mtDNA4977bp缺失片段的灰度值与mtDNA内参片段的灰度值之比来确定DNA模板中存在的mtDNA4977bp缺失占总mtDNA的比例。
1.5 统计学处理每份样品均设计6个平行样, n=6。实验数据以均值±标准差(x±s)表示, 采用SPSS13.0软件进行单因素方差分析比较存活分数、mtDNA4977bp缺失率。
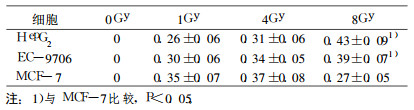
2 结果 2.1 γ射线照射后肿瘤细胞的存活分数肿瘤细胞在不同剂量照射后的存活分数, 见表 2。在同一剂量HepG2的存活分数最低, MCF-7的最高, EC-9706介于二者之间。在2Gy、4Gy和8Gy照射后, HepG2和EC-9706的存活分数与MCF-7相比差异有统计学意义(P<0.05及P<0.01), 表明HepG2和EC- 9706的辐射敏感性比MCF-7高, 而HepG2和EC-9706的存活分数差异无统计学意义(P>0.05)。
|
|
表 2 肿瘤细胞在γ射线照射后的存活分数(x±s) |
γ射线照射后普通PCR扩增肿瘤细胞mtDNA内参片段处于500~750 bp分子量标准之间, 与其理论值533bp片断大小基本吻合。3轮巢式PCR的终产物(跨越4977bp缺失片段)在250~500 bp之间, 约在391bp位置, 与预计长度基本一致, 而照射前细胞PCR扩增无391bp, 表明未受照细胞不发生mtDNA4977bp缺失。随着照射剂量的加大, 3种肿瘤细胞mtDNA4977bp缺失有所增加, 见表 3。1Gy和4Gy照射后肿瘤细胞的mtDNA4977bp缺失率在统计上差异无统计学意义(P>0.05)。8Gy照射后HepG2和EC- 9706 mtDNA4977bp缺失进一步增加, 而MCF-7的缺失率下降, HepG2与EC-9706和MCF-7相比有统计学差异(P<0.05), 表明HepG2和EC-9706的辐射敏感性比MCF-7高, 但HepG2和EC-9706的缺失率差异无统计学意义(P>0.05)。
|
|
表 3 γ射线照射后肿瘤细胞mtDNA4977bp缺失率(x±s) |
mtDNA4977bp缺失是电离辐射引起的最为常见的突变[6], 该缺失位于mtDNA碱基序列中的13bp的正向重复序列, 即8 470~8 482和13 447~13 459bp之间[7]。本研究采用巢式PCR技术, 扩增电离辐射诱导肿瘤细胞株mtDNA4977bp缺失, 克服了普通PCR方法的结果受到许多因素的影响而不稳定的缺点, 提高了检测结果的可靠性[8]。本研究发现1~8Gyγ射线照射后肿瘤细胞都发生mtDNA4977bp的缺失, 验证了电离辐射可诱导mtDNA4977bp缺失的发生, 同时也提示mtDNA4977bp缺失可能是辐射损伤的标志之一。Kubota[3]等的研究认为, 可以根据能够诱导处mtDNA4977bp缺失的辐射剂量的大小来判断细胞的辐射敏感性。结合本研究结果, 我们认为, 在非定量条件下, 可以采用Kubota等的方法来判断细胞的辐射敏感性, 而在定量条件下, 可以在某特定剂量照射后, 对诱导出的mtDNA4977bp缺失进行定量分析, 进而判断不同细胞的辐射敏感性。
用MTT法计算2Gy照射时的细胞存活率(SF2), 被认为是比较经典可靠的判断细胞辐射敏感性的方法, 只是这种方法需要细胞培养, 比较耗时, 所以限制了该方法在临床上的广泛应用。在本研究中, 采用该方法作为对照方法。MTT方法得到的SF2越小, 说明细胞对射线越敏感。本研究得出HepG2、EC- 9706和MCF-7的SF2分别为0.53、0.58和0.79。HepG2的SF2最小, 而MCF-7的SF2最高, 表明HepG2具有较高的辐射敏感性, 而MCF-7对射线的敏感性最低。同样, 4Gy和8Gy照射后, HepG2和EC-9706表现出来的辐射敏感性同样比MCF -7高。mtDNA4977bp缺失结果表明, 在1Gy和4Gy照射后不能确定肿瘤细胞的辐射敏感性, 而在8Gy照射后HepG2和EC -9706的辐射敏感性比MCF-7高, 这与MTT法结果一致。但两种方法都发现HepG2和EC-9706的敏感性无差异, 具有一致性。上述结果表明, 为了更准确地反映肿瘤内在敏感性, 选取两个或多个生物标志物联合测定是明智的。这方面的工作还需要通过大量实验研究, 调整照射剂量和实验条件, 提高预测肿瘤细胞辐射敏感性的准确性和实用性。
| [1] |
Bergqvist M, Brattstrom D, Stalberg M, et al. Evaluation of radiation-induced DNA damage and DNA repair in human lung cancer cell lines with different radiosensitivity using alkaline and neutral single cell gel electrophoresis[J]. Cancer Lett, 1998, 133: 9-18. DOI:10.1016/S0304-3835(98)00178-5 |
| [2] |
Wada S, Kurahayashi H, Kobayashi Y, et al. The relationship between cellular radiosensitivity and radiation-induced DNA damage measured by the comet assay[J]. J Vet Med Sci, 2003, 65(4): 471-477. DOI:10.1292/jvms.65.471 |
| [3] |
Kubota N, Hayashi JI, Inada T, et al. Induction of a particular deletion in mitochondrial DNA by X rays depends on the inherent radiosensitivity of the cells[J]. Radiat Res, 1997, 148(4): 395-498. DOI:10.2307/3579525 |
| [4] |
Marcon F, Andreoli C, Rossi S, et al. Assessment of individual sensitivity to ionizing radiation and DNA repair efficiency in a healthy population[J]. Mutat Res, 2003, 541(1-2): 1-8. DOI:10.1016/S1383-5718(03)00171-2 |
| [5] |
Habano W, Sugai T, Nakamura S, et al. Microsatellite instability and mutation of mitochondrial and nuclear DNA in gastric carcinoma[J]. Gastroenterology, 2000, 118: 835-841. DOI:10.1016/S0016-5085(00)70169-7 |
| [6] |
Chinnery PF, Samuels DC, Elson J, et al. Accumulation of mitochondrial DNA mutations in ageing, cancer, and mitochondrial disease:is there a common mechanism[J]. Lancet, 2002, 360(9342): 1323-1325. DOI:10.1016/S0140-6736(02)11310-9 |
| [7] |
Von Wurmb-Schwark N, Higuchi R, Fenech AP, et al. Quantification of human mitochondrial DNA in a real time PCR[J]. Forensic Sci Int, 2002, 126: 34-39. DOI:10.1016/S0379-0738(02)00026-9 |
| [8] |
封江彬, 陆雪, 陈德清, 等. 巢式PCR分析电离辐射诱导人外周血线粒体DNA4977bp缺失[J]. 中华放射医学与防护杂志, 2004, 24(6): 533-536. DOI:10.3760/cma.j.issn.0254-5098.2004.06.017 |