2. 中国医学科学院中国协和医科大学放射医学研究所分子核医学重点实验室, 天津 300192
线粒体基因是独立于核外的唯一遗传物质, 由于其结构和功能的特点, 较核DNA发生基因突变的频率明显增高, 其中具有代表性的是线粒体DNA(mitochondrial DNA, mtDNA)4977 bp的缺失。大量研究表明, 此缺失在一定程度上可以作为年龄、光老化和生物能量学疾病等方面的生物标记, 但是有关其辐射生物学的研究并不多。本实验应用巢式PCR技术检测经X射线照射后肿瘤细胞mtDNA4977bp缺失, 根据剂量效应关系判断肿瘤细胞的辐射敏感性, 初步探讨电离辐射致mtDNA4977bp缺失检测用于预测肿瘤细胞辐射敏感性的可行性。
1 材料与方法 1.1 细胞系与细胞培养人肝癌细胞系HepG2 (中国医学科学院放射医学研究所提供), 人前列腺癌细胞系PC-3 (天津市泌尿外科研究所惠赠)。细胞培养用RPMI1640培养基(GIBCO公司), 含10℅小牛血清(杭州四季青公司)、100U/ml青霉素、100μg/ml链霉素, 置于37℃、5℅ CO2、饱和湿度的培养箱中培养, 隔天用0.25%胰蛋白酶消化传代。
1.2 主要仪器直线加速器(Varian 600C美国)、酶标仪(Thermo MK3美国)、低温超速离心机(Hitachi SCR20BA日本)、紫外分光光度计(Beckman DU800美国)、PCR仪(Thermo美国)、凝胶图像处理系统(Bio_Rad DOC1000美国)。
1.3 细胞照射取对数生长期的细胞, 将培养瓶翻转平放, 上面放置1.5cm厚的有机玻璃板, 射野10cm×10cm, 源皮距100cm, 用6MV-X射线在室温环境中照射细胞, 剂量分别为2Gy、4Gy、8Gy、12Gy和16Gy, 剂量率为320cGy/min。未照射对照组置于相同环境中。
1.4 细胞mtDNA提取细胞照射后在37℃培养箱中放置2h, 然后消化离心获得大于5×106个细胞的沉淀。参照文献[1] "改进高盐沉淀法"的具体步骤提取mtDNA, -20℃保存提取样品。用BECKMAN DU800紫外分光光度计测定其含量。
1.5 PCR扩增 1.5.1 引物的设计与合成普通PCR扩增内参片段:内参引物对扩增mtDNA中某一稳定的片段, 代表反应体系中总mtDNA含量, 作为内参计算发生mtDNA4977bp缺失基因的比例。巢式PCR扩增mtDNA4977bp缺失片段, 引物对位于缺失片段两端附近, P1引物对在模板最外侧, P3引物对在模板最内侧。分别用P1、P2、P3引物对进行巢式第1、2、3轮PCR扩增。在限制PCR反应条件下, 较短的延伸时间DNA聚合酶不能够扩增出约5kb的片段, 因此在巢式PCR反应中, 未发生mtDNA4977bp缺失的线粒体基因模板不能扩增出片段, 而理论上无论是否存在mtDNA4977bp缺失, 线粒体基因模板均能用普通PCR扩增出内参片段。所有引物由上海捷瑞生物工程公司合成。
|
|
表 1 PCR扩增mtDNA的引物 |
巢式PCR第一轮扩增加入提取的模板200ng, 第二轮和第三轮扩增分别加入前一轮扩增产物1ul作为模板; 普通PCR加入提取的模板25ng。反应体系包含10× PCRbuffer(无Mg2+) 5μl, , 20mM MgCl2 2μl, dNTPmix 1μl, Taq DNA聚合酶0.5μl(2.5U), 两端引物各1μl, 最后加H2O补足总体积至50μl。
1.5.3 PCR反应条件普通PCR反应条件:第1个循环94℃变性5min, 55℃退火5min, 72℃延伸3min; 第2~25个循环为94℃变性40s, 55℃退火40s, 72℃延伸50s;最后72℃延伸10min。巢式PCR第1轮反应条件:先94℃预变性3min; 然后94℃变性1min, 45℃退火1min, 72℃延伸1min, 共35个循环; 最后72℃延伸10min。第2、3轮反应条件均为先94℃预变性3min; 然后94℃变性40s, 45℃退火40s, 72℃延伸40s, 共35个循环; 最后72℃延伸10min。
1.5.4 DNA缺失定量分析扩增产物在1%琼脂糖凝胶(含0.5μg/ml的EB)中电泳, 用Doc1000凝胶成像系统采集图像, 用Molecular AnalysisTM软件分析电泳条带的灰度值, 用mtDNA4977bp缺失片段的灰度值与mtDNA内参片段的灰度值之比代表总体线粒体模板中存在mtDNA4977bp缺失的模板所占的比例。
1.6 统计学处理实验数据以均值标准差(x±s)表示, 采用SPSS12.0软件进行统计分析, 以P<0.05表示差异有统计学意义。
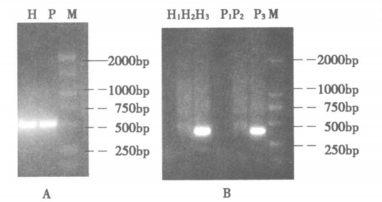
2 结果 2.1 缺失片段肿瘤细胞经X射线照射后分别用普通PCR扩增mtDNA内参和用巢式PCR扩增发生mtDNA4977bp缺失的片段, 以8Gy照射为例, 普通PCR扩增内参片段处于500~750bp之间, 与理论长度533bp片段位置一致(见图 1A); 巢式PCR第1、2轮扩增产物从图像中未显现, 第3轮扩增产物在250-500bp之间, 与理论长度391bp位置吻合(见图 1B)。
|
图 1 PCR扩增肿瘤细胞mtDNA内参片段和mtDNA4977bp缺失片段的琼脂糖凝胶电泳图 M:DL2000 DNA标准H:HepG2 P:PC-31:第1轮产物2:第2轮产物3:第3轮产物 |
经X射线照射后两种肿瘤细胞mtDNA4977bp缺失率升高, 说明X射线能诱导mtDNA4977bp缺失的发生, 并且随照射剂量的增加, HepG2和PC-3细胞mtDNA4977bp缺失率均有不同程度的升高。与其对照组比较, 差异有统计学意义(P<0.05), 见表 2。
|
|
表 2 照射后肿瘤细胞mtDNA4977bp缺失率 |
两种肿瘤细胞在未照射组均检测出mtDNA4977bp缺失, 即基础缺失率。本实验HepG2和PC-3的平均基础缺失率为0.6217和0.7383, 比较两种细胞辐射敏感性之前, 应排除基础缺失率的干扰, 即扣除各自基础缺失率后得出由辐射诱导的mtDNA4977bp缺失率。如图2所示, HepG2细胞mtDNA4977bp缺失率随照射剂量的增加呈升高趋势。PC-3细胞在较低剂量范围(0~8Gy)mtDNA4977bp缺失率随剂量变化不显著, 8Gy照射后缺失率比4Gy略有下降; 较高剂量范围(8~16Gy)照射后的缺失率显著升高, 表明PC-3细胞的mtDNA4977bp缺失累积主要发生在相对高剂量范围。HepG2细胞在各剂量点的缺失率均显著高于PC-3细胞(P<0.05), 提示HepG2细胞的辐射敏感性高于PC-3细胞。
3 讨论有文献报道肿瘤组织存在mtDNA4977bp缺失, 肿瘤细胞增值过程中, 遗传方面、不确定的环境因素和氧化应激等都可能会引起mtDNA4977bp缺失的增加。本实验中两种肿瘤细胞未照射组也检测到此缺失的存在。Kamalidehghan等[2]检测到胃癌组织的mtDNA4977bp缺失低于癌旁组织和正常组织, 可能是含有mtDNA4977bp缺失的肿瘤细胞由于线粒体功能缺陷, 不能像其他肿瘤细胞一样无限增值。Yang等[3]则发现皮肤肿瘤的mtDNA4977bp缺失与光暴露皮肤无差别, 认为可能是光照射引起的缺失增多。目前对于肿瘤组织的基础缺失率尚缺乏明确的认识, 而且不同种类的细胞基础缺失率不尽相同, 校正基础缺失率是准确判断细胞缺失对射线敏感性的前提, 我们在比较肿瘤细胞辐射敏感性之前, 分别扣除各自基础缺失率, 避免基础缺失率的差异影响统计结果的准确性。
有关辐射诱导细胞mtDNA4977bp缺失的研究发现, 缺失可以累积并且与辐射剂量有关。Prasanna等[4]分析间期淋巴细胞mtDNA4977bp的缺失可准确估算0.25Gy~2Gy之间急性照射的剂量, 提示辐射剂量与缺失之间有明确的剂量效应关系。本实验结果也得出两种细胞的缺失率具有剂量依赖性, 尤其是HepG2细胞在0Gy~16Gy和PC-3细胞在8Gy~16Gy剂量范围。本实验用mtDNA4977bp缺失率代表基因辐射损伤程度来判断细胞放射敏感性, 得出HepG2细胞的放射敏感性高于PC-3细胞, 这与石卫民等[5]和廖安燕等[6]通过克隆形成法分别测定体外HepG2和PC-3细胞的辐射敏感性结果一致。同时与临床肿瘤放射治疗的一般印象相吻合。
本实验PC-3细胞经8Gy照射后的缺失率略低于4Gy, 我们认为除了实验误差外, 还可能是PC-3细胞经8Gy辐射mtDNA4977bp缺失及其累积不稳定, 需要更精细的剂量划分和大量实验验证。Prithivirajsingh等[7]应用PCR检测分别经2、5、10和20 Gy照射后的五种人肿瘤细胞系的mtDNA4977bp缺失情况, 未发现辐射诱导mtDNA 4977 bp缺失与剂量之间的联系。可见并非所有肿瘤细胞或者任何剂量范围都存在明显剂量依赖关系, 因此选择合适的肿瘤细胞和存在明显剂量效应关系的辐射剂量范围, 是能否准确预测放射敏感性的关键因素。本实验仅处于初步探讨阶段, 有待深入研究, 建立一套成熟的检测技术和准确的评价体系, 供肿瘤临床个案化和预测疗效之用。
| [1] |
李伟文, 陆松敏, 刘建仓, 等. 线粒体DNA提取方法的比较[J]. 国外医学(分子生物学分册), 2003(3): 191-193. DOI:10.3870/j.issn.1672-8009.2003.03.022 |
| [2] |
Kamalidehghan B, Houshmand M, Ismail P, et al. Delta mtDNA4977 is more common in non-tumoral cells from gastric cancer sample[J]. Archives of medical research, 2006, 6(6): 730-735. |
| [3] |
Yang JH, Lee HC, Chung JG. Mitoehondrial DNA mutations in light-associated skin tumors[J]. 2004, 4(3a): 1 753-1 758. https://www.researchgate.net/publication/8436063_Mitochondrial_DNA_mutations_in_light-associated_skin_tumors
|
| [4] |
Prasanna PG, Hamel CJ, Escalada ND, et al. Biological dosimetry using human interphase peripheral blood lymphocytes[J]. Military Medicine: Official Journal of AMSUS, The Society of the Federal Health Agencies, 2002, 167(2 Suppl): 10-12. |
| [5] |
石卫民, 范义湘, 陈龙华. 两株人肝癌细胞放射敏感性的体外研究[J]. 中国现代医学杂志, 2001(9): 6-7. DOI:10.3969/j.issn.1005-8982.2001.09.003 |
| [6] |
廖安燕, 王俊杰, 赵勇, 等. 125I粒子持续低剂量率照射对人前列腺癌细胞的抑制作用[J]. 中华放射医学与防护杂志, 2007(3): 226-228. DOI:10.3760/cma.j.issn.0254-5098.2007.03.004 |
| [7] |
Prithivirajsingh S, Story MD, Bergh SA, et al. Accumulation of the common mitochondrial DNA deletion induced by ionizing radiation[J]. FEBS Letters, 2004, 571(1-3): 227-232. DOI:10.1016/j.febslet.2004.06.078 |






