2. 宜昌市中心医院;
3. 宜昌市夷陵医院
骨桥蛋白(osteopontin OPN)是一种重要的细胞外基质蛋白, 具有抑制细胞凋亡, 促进细胞增殖和新生血管形成等多种生物学作用。特别是近年来研究发现OPN与肿瘤细胞生长、增殖和侵袭、转移密切相关[1]。文献报道[2] OPN的表达与非小细胞肺癌(NSCLC)的发生、发展和淋巴结转移有密切关系, 可作为临床评估NSCLC进展和预测肿瘤转移潜能的指标。血管内皮生长因子-C(vascular endothelial growth factor C, VEGF -C)是特异的促淋巴管内皮生长因子和肿瘤血管生成标志物, 它参与非小细胞肺癌(NSCLC)新生淋巴管的形成, 与NSCLC的淋巴转移密切相关, 在NSCLC的浸润、进展中发挥重要作用[3]。笔者应用免疫组化PV法检测OPN和VEGF-C在42例NSCLC中的表达水平, 探讨周围型非小细胞肺癌CT征象与OPN、VEGF-C表达的关系, 以期用CT扫描这种无创性的检查方法为评估肺癌的恶性生长特性及预测肺癌患者的预后提供帮助。
1 材料与方法 1.1 一般资料收集2003年7月至2007年3月间经胸外科行手术切除、术前行CT检查并经病理证实的42例术前未经化疗、放疗的周围型非小细胞肺癌患者, 其中男33例, 女9例。年龄28~ 78岁, 平均58.2岁。病理组织学类型:鳞癌32例, 腺癌9例, 巨细胞癌1例。病理分级:Ⅰ级10例, Ⅱ级18例, Ⅲ级14例。全部标本均为石蜡切片, 切片厚度4μm。
1.2 试剂鼠抗人OPN单克隆抗体(克隆系OP3N), 兔抗人VEGF-C多克隆抗体及PV系列工作液试剂盒均从北京中杉金桥生物技术有限公司购买。
1.3 OPN和VEGF-C免疫组化测定方法免疫组化采用PV法染色, 按照厂家提供的说明书进行操作。
1.4 OPN和VEGF-C结果判定OPN、VEGF-C阳性染色主要为细胞质内出现棕黄色颗粒, OPN主要定位于肿瘤细胞和肺泡内巨噬细胞胞浆内。VEGF-C主要位于肿瘤细胞和脉管内皮细胞胞浆内。OPN、VEGF-C分别按照Wai[1]和Tang[4]的评判方法和标准来判定结果。
1.5 CT扫描技术使用GE light speedQx/iCT机, 常规肺部扫描, 厚层5mm, 层距5mm。肺窗观察肿瘤边缘征象及肺野变化, 纵隔窗观察肿瘤边缘征象、内部结构、纵隔和肺门淋巴结情况。CT征象评定标准参照文献[5], 淋巴结转移以淋巴结短径≥10mm作为CT诊断标准。
1.6 统计学方法应用χ2检验、非参数秩和检验对数据进行处理。统计学意义水平设为P < 0.05。
2 结果(1) OPN与VEGF-C在非小细胞肺癌组织中的表达与其病理类型、分化程度、淋巴结转移的关系见表 1。OPN和VEGF -C的表达在非小细胞肺癌不同组织类型间及不同细胞分化程度间无显著统计学意义(P>0.05), 但在淋巴结转移阳性组表达显著高于无淋巴结转移组(P < 0.05)。
|
|
表 1 OPN、VEGF-C的表达与肺癌病理有关指标的关系 |
(2) OPN和VEGF-C在周围型非小细胞肺癌中的表达与CT征象之间的关系见表 2。在本组周围型非小细胞肺癌病例CT征象中, 肿瘤直径>3.0cm、深分叶征、棘突征及纵隔淋巴结肿大与OPN和VEGF-C的阳性表达均有显著统计学意义(P < 0.05)。而与毛刺征、空洞征均无统计学意义(P>0.05)。OPN的表达与胸膜外脂肪线消失有显著统计学意义(P < 0.05), OPN的表达与血管集束征有显著统计学意义(P < 0.05)。
|
|
表 2 CT征象与OPN和VEGF-C表达的关系 |
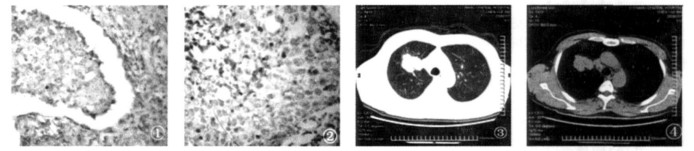
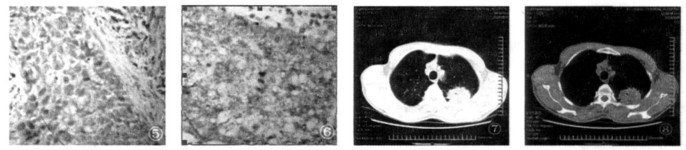
(3) 本研究显示有深分叶征、棘突征、血管集束征, 胸膜外脂肪线消失的病例OPN、VEGF-C的阳性表达显著增高, 提示有上述征象的周围型肺癌可能有更高的恶性生长生物学特性(见图① ~ ⑧)。
|
图 ①~④ 为同一病例右上肺鳞癌,①OPN阳性(+++),②VGEF-C阳性(++),③④CT肺窗和纵隔窗,示肿瘤呈深分叶,边缘呈棘状突起和毛刺,并有纵隔淋巴结肿大。 |
|
图 ⑤~⑧ 为同一病例左上肺鳞癌,⑤OPN阳性(++),⑥VGEF-C阳性(+++),⑦⑧为CT肺窗和纵隔窗,可见肿瘤血管集束,棘突及胸膜外脂肪线消失,且见空泡征。 |
大多数恶性肿瘤的发生、发展和转移是多种因素和多种生物学因子共同作用、共同参与的结果, 各种生物学因子单独或共同作用决定肿瘤的恶性生长方式、生长速度、形态特征、细胞分化程度、转移和复发等生物学特性, 而由这些生物学行为所决定的肿瘤组织的大体形态改变正是CT征象的基础。OPN作为一种细胞外基质蛋白和细胞因子, 与非小细胞肺癌病理类型、TNM分期、淋巴结转移密相关[1]; OPN通过细胞粘附序列RGD和非RGD序列与细胞表面整合素受体(如αVβ 3, αVβ 5)和透明质酸受体CD44V6结合, 参与细胞的粘附、迁移和增殖, 促进恶性肿瘤的发展, 使肿瘤发生浸润和转移[6, 7]; 与血管通透因子(VPF)/血管内皮因子(VEGF)发挥协同作用, 促进内皮细胞的增生, 诱使新血管生成, 有利于肿瘤细胞生长和转移[8]。VEGF-C是VEGF家族可特异性作用于淋巴管内皮的成员, 在介导肿瘤淋巴管生成、促进肿瘤淋巴道转移过程中发挥重要作用。并具有促进肿瘤细胞生长、抑制细胞凋亡、促进肿瘤血管生成及肿瘤血行转移等作用。其表达水平与肿瘤血管生成及淋巴结转移呈正相关[9, 10]。笔者选取OPN、VEGF-C与肿瘤浸润、转移密切相关的指标, 旨在探讨其表达水平与非小细胞肺癌CT征象之间的联系。
本组对42例周围型非小细胞肺癌OPN、VEGF-C表达水平的检测结果表明, OPN、VEGF-C的表达与周围型非小细胞肺癌的组织类型、细胞分化程度均无明显统计学意义(P> 0.05), 而与淋巴结转移有显著统计学意义(P < 0.05)。本组结果显示OPN与组织类型无明显相关性, 这与目前大部分关于OPN与肺癌文献报道不尽一致, 可能与本组病例主要为肺鳞癌, 腺癌病例偏少有关。OPN与细胞分化程度、淋巴结转移的关系与目前文献报道一致。本组病例VEGF-C的表达与组织类型、分化程度及淋巴结转移的关系与目前相关文献报道基本一致。表明OPN、VEGF-C可作为判断非小细胞肺癌转移及预后的指标, 也为研究CT征象与周围型肺癌恶性生长方式的关系提供了理论基础。
Nowell[11]认为肿瘤在3.0cm大小时可能是其生物学特性发生转变的重要时期, 即肿瘤直径>3.0cm时可能是处于低度恶性向高度恶性转变的时期, 肿瘤的侵袭力更强, 更易发生转移。本研究结果显示肿瘤直径>3.0cm组, OPN、VEGF-C的表达明显高于直径≤ 3.0cm组, 提示周围型非小细胞肺癌> 3.0cm时恶性程度更高, 侵袭和转移能力更强。
CT征象的深分叶征是指肿瘤边缘凹凸不平, 呈花瓣样突出, 弦距与弦长之比≥ 0.4, 有学者经病理对照研究发现分叶征是由于肿瘤多核发病及相互融合或瘤体各部分生长速度不均衡而形成, 也与肿瘤生长过程中受肺的结缔组织间隔、支气管、血管阻挡引起肿瘤生长局部受限有关, 表明位于肿瘤边沿分叶处的肿瘤细胞生长更活跃, 增殖速度更快。深分叶征对周围型非小细胞肺癌的诊断有非常重要的价值。棘突征是指纵隔窗表现为自肿瘤边缘突向肺野, 形态介于分叶与毛刺之间呈尖角样的棘状突起, 被认为是分叶的一部分。是肿瘤发育的先端部位, 代表肿瘤细胞在血管周围的结缔组织内浸润和沿淋巴管蔓延。本研究显示有深分叶征、棘突征的病例OPN、VEGF-C的阳性表达显著增高, 提示有深分叶征和棘突征的周围型肺癌可能有更高的恶性生长生物学特性。
毛刺征。从肺窗观察, 毛刺征表现为自肿瘤边缘向周围肺伸展, 呈放射状、无分支的细短线条影, 常规10mm层厚CT扫描多表现为晕圈状或毛刷状, 高分辨CT扫描毛刺征检出率较高。一般认为肺肿块周围见毛刺影高度提示恶性。但本研究结果未显示OPN、VEGF-C的表达与毛刺征形成的相关性。
血管集束征。是指肺癌肿块与肺内血管的关系。病理研究表明, 集束征由增粗的血管组成, 近肺门侧的血管束多由血管、支气管构成; 远肺门侧的血管束则由扩张的小静脉组成, 可能与静脉回流受阻有关。本研究结果显示OPN与血管集束征无明显相关性, 但VEGF-C的表达与该征象形成有密切关系; 因而作者推测血管集束征的组成可能有新生淋巴管的参与, 这有待进一步病理研究证实。
胸膜外脂肪线消失。文献报道该征象诊断非小细胞肺癌的准确度为77%, 灵敏度为40%。胸膜外脂肪线消失提示瘤细胞已浸润壁层胸膜, 其临床TNM分期已达T3期, 因而它能为判断非小细胞肺癌的恶性度及临床分期提供有价值的依据。本研究结果显示OPN与胸膜外脂肪线的消失有显著相关性。而VEGF-C的表达与此征象未显示明显相关性。表明OPN高表达的非小细胞肺癌更具侵袭性、具有更高的恶性程度。
空洞征。CT表现为厚壁或厚薄不均(0.5 ~ 3.0cm); 内壁凹凸不平, 或呈结节状; 外壁呈波浪状或分叶状; 大多为中心性, 少数为偏心性, 大小不一; 一般认为这类空洞多系肺大泡或支气管囊肿内发生肺癌; 另一种可能是肿瘤内广泛坏死, 或肿瘤压迫、阻塞临近支气管致肺气肿、肺大泡形成以后肿瘤向肺大泡壁靠近生长而成。空洞壁的厚度和壁结节对良、恶性病变的鉴别有一定的意义。本研究结果未显示OPN、VEGF-C与空洞的形成有相关性。
纵隔淋巴结肿大。CT对纵隔、肺门淋巴结肿大的诊断准确率较高。有学者将淋巴结>10mm作为判断淋巴结肿大的标准, 考虑有淋巴结转移的可能, 其敏感性为67.85%, 特异性为96.29%, 准确率达81.80%。本结果显示有纵隔淋巴结转移组的OPN、VEGF-C的表达高于无纵隔淋巴结转移组, 两者有显著统计学意义。表明OPN、VEGF-C两者在促进淋巴结转移过程中发挥重要作用。
因此, OPN、VEGF-C的阳性表达与周围型非小细胞肺癌的深分叶征、棘突征、纵隔淋巴结肿大有明显相关性; 与毛刺征、空洞征无关; OPN与胸膜外脂肪线消失有关; VEGF-C与血管集束征形成有关。表明深分叶征、棘突征、胸膜外脂肪线消失、血管集束征、纵隔淋巴结肿大能提示肿瘤有较高的恶性程度和较强的侵袭及转移能力, 且预后较差。
| [1] |
Wai PY, Kuo PC. The role of osteopontin in tumour metastasis[J]. J Surg Res, 2004, 121(2): 228-241. |
| [2] |
杨艳娟, 张锦. 骨桥连接素(OPN)在肺癌中的表达及其临床病理学意义[J]. 宁夏医学杂志, 2004, 26(12): 759-760. DOI:10.3969/j.issn.1001-5949.2004.12.005 |
| [3] |
Kajita T, Ohta Y, Kimura K, et al. Expression of vascular endothelial growth factor C and its receptors innon-small cell lung cancer[J]. Br J Cancer, 2001, 85(2): 255-260. DOI:10.1054/bjoc.2001.1882 |
| [4] |
Tang R F, Itakura J, Aikawa T, et al. Overexpression of lymphangiogenic growth factor VEGF-C in human pancreatic cancer[J]. Pancreas, 2001, 22(3): 285-292. DOI:10.1097/00006676-200104000-00010 |
| [5] |
周康荣. 胸部颈面部CT[M]. 上海医科大学出版社, 1996: 38-43. Zhou KR. CT of the thorax neck and ENT[M]. Shanghai Medical University press, 1996: 38-43. |
| [6] |
Denhardt DT, Giachelli CM, Rittling SR. Role of osteopontin in cellular signaling and toxicant injury[J]. Annu Rev Pharmacol Toxicol, 2001, 41: 723-749. DOI:10.1146/annurev.pharmtox.41.1.723 |
| [7] |
Weber GF, Ashkar S, Glimcher MJ, et al. Receptor-ligand interaction between CD44 and osteopontin(Eta-1)[J]. Science, 1996, 271(5248): 509-512. DOI:10.1126/science.271.5248.509 |
| [8] |
Hirama M, Takahashi K, Takahashi F, et al. Osteopontin overproduced by tumour cells acts as a potent angiogenic factor contributing to tumour growth[J]. Cancer Lett, 2003, 198: 107-117. DOI:10.1016/S0304-3835(03)00286-6 |
| [9] |
董昕, 邱雪杉, 王恩华, 等. 血管内皮细胞生长因子C及其受体3在非小细胞肺癌组织中的表达及意义[J]. 中华病理学杂志, 2003, 32(2): 128-132. DOI:10.3760/j.issn:0529-5807.2003.02.007 |
| [10] |
陆婉玲. 血管内皮生长因子C与肺癌关系的研究进展[J]. 中国实用内科杂志, 2006, 26(24): 1 982-1 984. |
| [11] |
Nowell PC. Mechanism of tumour progression[J]. Cancer Res, 1986, 46(5): 2203-2207. |