在实体肿瘤中, 由于瘤体内部血供的不同, 使得肿瘤细胞部分处于富氧状态、部分处于乏氧状态, 部分处于乏氧再氧合状态。正是这些乏氧细胞的存在导致了肿瘤对放射治疗的抵抗, 目前乏氧引起放疗抵抗性增加的确切机制尚不明了, 但近期研究表明在这个过程中低氧诱导因子-1α(HIF-1α)起着中枢纽带作用, 它是肿瘤适应缺氧、产生一系列缺氧行为的中心环节, 可以诱导p53等多种基因的表达, HIF-1α、p53同时还是影响肿瘤细胞凋亡的重要因素, 是参与细胞凋亡的重要因子之一[1]。
本实验将通过模拟实体瘤内部, 处于三种不同氧供状态下的细胞模型, 观察此三种状态下60Coγ射线照射诱导Hep-2细胞凋亡的作用, 并以p53蛋白为切入点, 探讨其作用机制。
1 材料与方法 1.1 试剂和仪器RPMI1640培养基(Gibco公司), 兔抗人HIF -1α多克隆抗体(武汉博士德生物工程有限公司), 鼠抗人p53多克隆抗体(北京中杉生物工程有限公司), 人喉鳞癌细胞Hep -2细胞株(白求恩国际和平医院中心实验室提供), 总RNA提取试剂, 第一链合成cDNA试剂盒(Fermentas)扩增试剂盒(Go Taq Green Master Mix Promega公司), 上、下游引物(北京奥科生物公司)。FACSort流式细胞仪(美国BD公司), FCC-8000型同中心回转式钴60治疗机(山东新华医疗器械股份有限公司)。Gene Amp PCR system 9600(美国Perkin Elmer), 凝胶成像分析系统GDS800(美国UVP公司), 酶标仪(华东电子仪器TCDZ302ZA)。
1.2 低氧条件设置低氧培养实验条件为37℃、5%CO2、2% O2、93%N2, 具体实验装置制作见参考文献[2]。
1.3 细胞分组及培养Hep-2细胞在37℃、5%CO2、20%O2环境中培养24h使细胞进入对数生长期后, 再将细胞分为A组(常氧组)、B组(低氧组)、C组(低氧再氧合组)。低氧条件下培养B、C组细胞24h。之后C组细胞再于常氧条件下继续培养4h, 三组细胞分别接受剂量5Gy的60Coγ射线照射, 照射后换新培养基继续培养24h, 收集各组细胞, 处理后进行各项指标的检测。每组实验均重复6次。
1.4 流式细胞仪(FCM)检测各组细胞凋亡及HIF-1α、p53蛋白的表达经上述处理后的细胞, 应用流式细胞仪进行检测。以488nm氩离子激光激发, 应用Expo32 ADC软件进行免疫荧光数据分析。
1.5 RT-PCR检测各组细胞HIF-1αmRNATrizol试剂一步法提取总RNA, β - actin作为内参照, 每个样本至少重复3遍。人HIF- 1α的引物序列及PCR反应条件参照文献[2]。
1.6 细胞爬片免疫组化检测HIF-1α、p53蛋白的表达将Hep-2细胞用RPMI1640培养液配成1 ×105个/ml悬液, 加入24孔培养板内的玻璃片上, 向每孔内的玻璃片上滴加一滴上述悬液, 5%CO2、37℃下培养4h, 倒致显微镜下观察玻璃片上细胞大部分已贴壁, 向每孔内加RPMI1640培养液约1 ml。5% CO2、37℃下培养24h, 观察细胞达80%汇合时, 将细胞分组, 相应条件下培养各组细胞, 之后三组细胞分别接受剂量5Gy的照射, 照射后换培养基继续培养24h, 吸出孔内原培养液, PBS冲洗一次, 甲醛固定10 min, PBS洗两次, 每次5 min, 取出爬片。免疫组化PV法染色。结果判断:以细胞内出现棕黄色颗粒为阳性表达, 以高倍视野(×400)下阳性细胞数量及颜色强弱作为综合判断, 采用半定量分析法, 每张切片光镜下随机选择10个视野, ①无染色记为0, 弱染色(浅黄色)记为1, 中等染色(棕黄色)记为2, 强染色(黄褐色)记为3。②阳性细胞小于视野总细胞数的5%记为0, 阳性细胞占视野总细胞数的5% ~ 24%记为1, 阳性细胞占视野总细胞数的25% ~ 50%记为2, 阳性细胞大于视野总细胞数的50%记为3。①、②两项结果相加结果为0, 代表阴性(-); 1 ~ 2(+); 3 ~ 4(++); 5 ~ 6, (+++)。
1.7 统计学方法应用SPSS11.0统计软件进行处理, 数据以均数±标准差(x±s)表示, 组间比较用t检验和χ2检验。
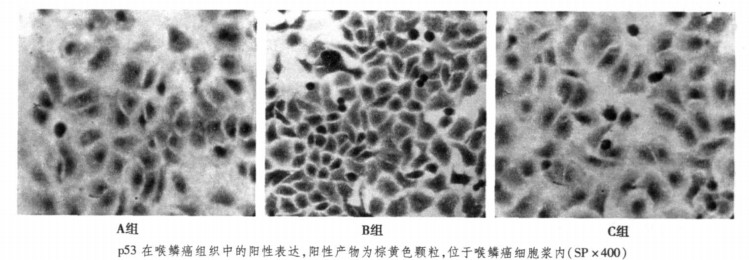
2 结果 2.1 各组喉鳞癌Hep-2细胞HIF-1α、p53蛋白的表达流式细胞检测结果显示:C组HIF-1α蛋白表达(1.36 ±0.53)明显低于B组(1.53 ±0.35)(P < 0.05), 但同A组(1.35 ± 0.27)相比差异无显著性; 同HIF-1α蛋白表达相似, C组p53蛋白的表达(1.08 ±0.31)明显低于B组(1.24 ±0.35)(P < 0.05), 但同A组(1.10 ±0.27)相比差异无显著性。免疫组化结果显示HIF-1α表达主要位于胞浆, 胞核内亦可见其表达, C组(++)HIF-1α的表达量明显低于B组(++++)。而同A组(++)组差异无显著性(见图 1); p53表达主要位于胞浆, C组(+)的表达量明显低于B组(+++), 同A组(+)组差异无显著性(见图 2)。

|
图 1 各组细胞HIF-1a蛋白的表达(5Gy) |
|
图 2 各组细胞p53蛋白的表达(5Gy) |
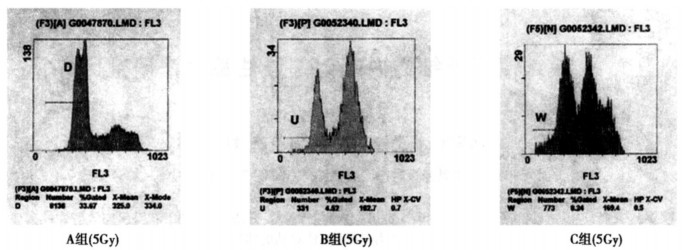
流式细胞术检测各组细胞的凋亡率, 结果显示低氧降低60Coγ射线照射对Hep-2细胞的诱凋亡作用, 再氧合之后其诱凋亡作用明显提高。(见表 1, 图 3)
|
|
表 1 各组细胞的凋亡率 |
|
图 3 各组细胞凋亡率(5Gy) |
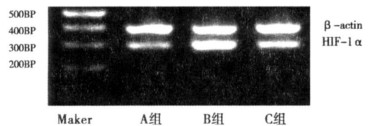
RT- PCR结果显示A(1.33 ±0.56)、C(0.91 ± 0.52)组HIF-1αmRNA的表达量均明显低于B组(1.74 ± 0.56)且P < 0.05差异有统计学意义。提示低氧能增加了Hep -2细胞HIF-1αmRNA表达, 再氧合之后HIF-1αmRNA表达明显降低(见图 4)。
|
图 4 RT-PCR检测HIF-1αmRNA的表达 |
射线导致细胞死亡的一个主要途径是激活细胞的凋亡机制[3]。细胞凋亡是在基因控制下, 通过主动的生化过程而发生自杀死亡的现象。p53基因参与射线引起的细胞凋亡, 它可使DNA受损的细胞增殖周期阻滞在G1期以进行DNA修复, 或启动细胞凋亡程序清除受损细胞[4]。许多实验表明, 电离辐射可以引起机体多种组织细胞凋亡。Stephens等在应用电离辐射诱导细胞凋亡的实验过程中, 观察到p53基因表达显著增强。说明p53基因是一个重要的细胞凋亡调节物, 其高表达可诱导细胞凋亡[5]。
由于在实体肿瘤中, 多数肿瘤细胞生长迅速, 血管的生长速度相对滞后, 加之肿瘤血管网结构和功能异常, 肿瘤组织间液压力升高, 使肿瘤血管内的血流处于波动状态, 发生间歇性血流停滞, 这些因素使得部分肿瘤的血供丰富、部分不足、部分时断时续。也就造成了内部肿瘤细胞部分处于富氧状态、部分处于乏氧状态, 部分处于乏氧再氧合状态。正是这些乏氧细胞的存在导致了肿瘤对放射治疗的抵抗, 目前乏氧引起放疗抵抗性增加的确切机制尚不明了, 但近期研究表明在这个过程中低氧诱导因子-1α(HIF-1α)起着中枢纽带作用, HIF-1a是目前所发现的介导细胞低氧反应最关键的转录因子, 它可在肿瘤形成、细胞凋亡、糖酵解和细胞周期的调控中产生直接效应, 并可以诱导p53等多种基因的表达, 与肿瘤恶性程度及放化疗抵抗密切相关, 给肿瘤治疗带来很大困难[6]。
但现在大多数的研究都只局限于常氧状态下体外培养的各种肿瘤细胞, 本实验将通过模拟实体瘤内部, 处于三种不同氧供状态下的细胞模型, 观察此三种状态下60Coγ射线照射诱导Hep-2细胞凋亡的作用, 并以p53蛋白为切入点, 探讨其作用机制, 将为肿瘤的放射治疗开辟新的领域。
本研究流式和免疫组化结果显示, B组HIF-1α蛋白表达明显高于A组, 说明低氧明显促进了Hep-2细胞HIF-1a蛋白的表达, 同时B组p53蛋白表达也明显高于A组, 再氧合之后HIF-1α及p53蛋白表达均呈现下调趋势, 提示HIF-1a与p53蛋白的表达可能存在正性相关, 此结果同梁磊的报道一致[7]。
低氧对HIF- 1α的调控, 目前研究观点认为发生在转录翻译后水平, 亦即蛋白质水平, 表现为HIF- 1α蛋白稳定性提高和HIF- 1α结合DNA活性的增强; 而在mRNA水平, 许多学者认为缺氧并不增加HIF- 1αmRNA的表达[9]。但本研究却发现低氧在明显促进Hep-2细胞HIF- 1α蛋白的表达的同时也使HIF- 1αmRNA的表达呈现上调的趋势, 此结果还有待于进一步的证实。
最近研究表明, 肿瘤细胞可以通过bax、bcl-2、p53、casepase等基因、蛋白的参与发生多种途径凋亡。我们研究发现, 低氧条件下培养的Hep-2细胞对60Coγ射线照射的抵抗能力明显增强, B组细胞的凋亡率明显低于A组, 提示低氧降低60Co γ射线照射对Hep-2细胞的诱凋亡作用。再氧合之后C组细胞的凋亡率明显高于B组, 60Coγ射线诱凋亡作用发生了明显提高。与A组相比, B组Hep-2细胞凋亡率明显降低的同时却并未出现p53蛋白表达的降低, 相反, 却出现了p53表达的增强, 而再氧合之后C组Hep-2细胞凋亡率明显升高的同时也并未出现p53蛋白表达的增强, 推测60Coγ射线诱导Hep-2细胞凋亡作用可能是通过p53以外的其它促凋亡途径实现的。但具体通过哪种途径来实现其促凋亡的机制及不同组织来源肿瘤是否表现不同的的个体差异均有待于进一步探讨。
笔者从低氧及低氧再氧合的角度探讨了HIF-1α、p53表达改变在60Coγ射线诱导Hep-2细胞凋亡中的作用, 提示可以将低氧诱导因子(HIF-1α)作为克服喉癌放疗抵抗的靶点, 通过增加肿瘤的氧供来提高放疗疗效。
| [1] |
Iida T, Mine S, Fujimoto H, et al. Hypoxia-inducible factor -1 alpha induces cell cycle arrest of endothelial cells[J]. Genes cells, 2002, 7(2): 143-149. DOI:10.1046/j.1356-9597.2001.00512.x |
| [2] |
Comer ford KM, Wallace TJ, Karhausen J, et al. Hypoxia-inducible factor-1 -dependent regulation of the multi drug resistance gene[J]. Cancer Res, 2002, 62(12): 3 387-3 394. |
| [3] |
Zhu WG, Aramaki R, Cai Y, et al. Promotion of heat induced apoptosis in FM 3A cells by protease inhibitions[J]. Biochern Biophys Res Commun, 2002, 225: 924-931. |
| [4] |
Sheng L, Guo J, Yang YM, et al. Study of p53, p14 gene expression in colonic cancer[J]. china Journal of Endoscopy, 2003, 9(10): 34-36. |
| [5] |
Stephens LC, Ang KK, Schulthesis TE, et al. Apoptosis in irradiated murine tumors[J]. Radiate Res, 2000, 127: 308-316. |
| [6] |
Comerford KM, Wallace TJ, Karhausen J, et al. Hypoxiainducible factor– i-dependent regulation of the multi drug resistance (MDR1) gene[J]. Cancer Res, 2002, 62(12): 33-37. |
| [7] |
梁磊. HIF-1A和P53蛋白在宫颈上皮内瘤样变及宫颈癌中的表达及意义[J]. 齐齐哈尔医学院学报, 2007, 28(2): 158-161. DOI:10.3969/j.issn.1002-1256.2007.02.012 |



 ,
, 