目前, 已有大量实验证明, 用照射后的细胞培养基培养未照射的其他细胞, 会降低该细胞的存活率甚至杀死该细胞[1-3]。同样的, 经过低剂量238Pu-α射线照射的CHO(中国仓鼠卵巢)细胞也出现了使未直接照射的旁细胞变异频率升高的现象[4], 并且使旁细胞细胞毒效应[5]及染色体的不稳定性增强[6]。尽管人们也努力去寻找旁效应的作用机理, 也有了一些发现, 如:活性氧的存在、核外信号分子通路等, 然而更进一步的机理却不得而知。本实验是在另外一个角度即通过对外周血各组分分离照射培养后, 采用单细胞凝胶电泳的方法对各组细胞在DNA水平上进行辐射损伤程度的评价, 为研究旁效应的机理奠定基础。
1 材料和方法 1.1 主要试剂和仪器正常熔点琼脂糖凝胶购自Biowest公司, 低熔点琼脂糖凝胶为Promega公司产品, Tris-HC1、DMSO和TritonX-100均为Sigma公司产品。水平电泳仪为BIORAD公司产品, 日本产Nikon荧光显微镜和数码相机, 137Cs辐射源购自加拿大原子能有限公司。
1.2 照射条件137Csγ射线均匀照射, 吸收剂量率:0.8451 Gy/min, 照射剂量为2Gy。
1.3 样品制备(图 1)
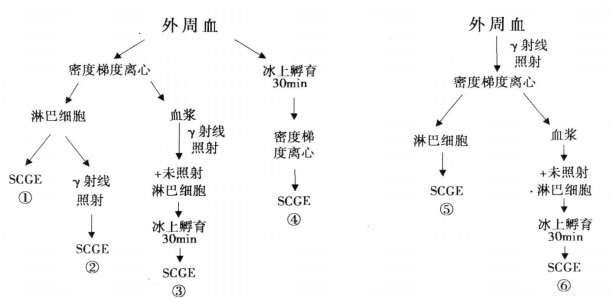
|
图 1 用于做单细胞凝胶电泳样品制备过程, 各数字代表用于检测的样品顺序 |
收集一个正常志愿者的外周血, 肝素抗凝, 分为两组, 一组照射, 一组不照射。两组血样分别加在等体积的淋巴细胞分离液面上, 用梯度离心法将其分层, 分别取上层血浆及中间层淋巴细胞。两组血浆均置于-20℃冰箱保存备用, 两组淋巴细胞置于2ml离心管中, 如图 1方式与不同的自体血浆在冰上共同孵育30min。孵育后的细胞加PBS, 1 500r/min离心6min, 弃上清。如此重复洗涤2次, 再将淋巴细胞悬于PBS, 调整细胞密度为2 ×104/ml后备用。
1.4 中性单细胞凝胶电泳实验参考Banath等的方法[7], 并稍加改良。
1.4.1 铺胶75%正常熔点琼脂凝胶煮沸后取100μl迅速均匀铺于自制微电泳槽内, 置于4℃冰箱1min使凝胶固化, 取制好的淋巴细胞悬液25μ与75μl0.75%低熔点琼脂凝胶混匀后铺于第一层凝胶上面, 置于4℃冰箱固化1min。
1.4.2 裂解将微电泳槽置于新鲜配制的中性裂解液中, 4℃冰箱中裂解1.5h。
1.4.3 电泳裂解后取出微电泳槽, 用双蒸水漂洗去掉多余的盐份, 置于提前加入4℃ 0.5%TBE电泳液的水平电泳仪中静置20min, 然后在20V, 200mA电泳条件下电泳20min。
1.4.4 染色和观察2μg/ml溴化乙锭(EB)染色, 双蒸水漂洗, 荧光显微镜下观察慧星, 用Nikon数码相机随机摄取彗星图像, 每个剂量点拍摄200个彗星图像。
1.5 彗星图像分析彗星图像采用波兰弗罗茨瓦夫(University of Wroclaw)大学提供的CASP系统[9]自动分析, 分析结果用SPSS12.0统计软件直接读取。选取彗星头部DNA百分含量(HDNA%)、尾矩(TM)和Olive尾矩(OTM)作为分析指标。
1.6 统计学处理用SPSS12.0统计软件对上述指标进行单因素方差分析, P < 0.05时则有统计学意义。2结果将各组培养的淋巴细胞用单细胞凝胶电泳分析方法分析, 并且经统计软件统计后的结果如图 2、表 1所示。
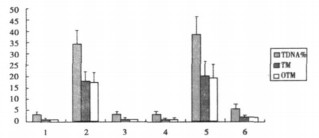
|
图 2 各组样品慧星图像分析结果 |
|
|
表 1 各样品间TDNA% /OTM/TM的P值比较 |
(1) 直接分离全血得到的淋巴细胞(样品1)、单独受照血浆培养的未受照淋巴细胞(样品3)以及未受照的血浆培养的未受照的淋巴细胞(样品4)均未表现出明显的辐射损伤现象, 并且三组样品之间DNA%/TM/OTM差异无显著性(P值分别为0.171/0.228/ 0.221、0.240/0.130/0.337及0.251/0.371/0.112)。
(2) 照射全血后分离的血浆培养的未受照淋巴细胞(样品6)的辐射损伤现象高于以上三组(样品1、样品3、样品4, P值分别为0.022/0.030/0.011、0.011/0.029/0.020、0.012/0.025/ 0.007)。
(3) 单独照射分离后的淋巴细胞(样品2)与照射全血后分离的淋巴细胞(样品5)均表现为明显拖尾现象, DNA%/TM/ OTM值明显高于其他各组, 但两组间差异却无显著性(P= 0.100/0.201/0.101)。
3 讨论在本实验中, 直接分离全血得到的淋巴细胞、单独受照血浆培养的未受照淋巴细胞以及未受照的血浆培养的未受照的淋巴细胞均未表现出明显的辐射损伤现象, 并且三组样品之间DNA%/TM/OTM无显著性差异, 说明血浆中没有参与辐射损伤旁效应的因素, 而且分离方法也未对淋巴细胞的DNA造成损伤, 这一点与NatarajanG[10]实验结果不一致, 说明本实验室采用的细胞分离方法不会对细胞造成额外损伤, 影响实验结果。另外, 由于照射全血后分离的血浆培养的未受照淋巴细胞出现了高于以上三组的DNA损伤, 因此, 在此组中, 有辐射旁效应存在, 并且很可能是因为辐照后的淋巴细胞自身释放的某些因子参与其中。
辐射非靶效应自1992年[1]提出后, 一直成为近年来辐射损伤研究的热点, 许多学者采用不同的生物学指标, 如细胞存活、基因突变、姐妹染色体互换、细胞增殖、细胞凋亡及基因组不稳定性等进行了研究, 均证实了辐射非靶效应的存在。到目前为止, 研究辐射非靶效应的实验方法大致有两种:一种是用带电粒子微束和微束培养皿进行实验, 一种用培养过受照细胞的培养基培养未受照细胞法, 其机制被认为有三种:活性氧作用、细胞因子作用、细胞间缝隙连接通讯。本实验采用自体受照血浆培养自体未受照淋巴细胞的方法, 真实还原了被测淋巴细胞的体内生存环境, 应用单细胞凝胶电泳方法从DNA分子损伤程度上再次证实了非靶效应的存在, 实验结果支持了细胞因子参与非靶效应的假说。
| [1] |
Bertho JM, Gourmelon P. Human thymic stromal cell irradiation reduces intra-thymic T cell precursor proliferation: evidence for asoluble mediator[J]. Int. J. Radiat. Biol., 1998, 74: 384-396. |
| [2] |
Rong Wang, Jeffrey AC. A bystander effect in alpha-particle irradiations of human prostate tumor cells[J]. Radiation research., 2005, 164: 711-722. DOI:10.1667/3475.1 |
| [3] |
Mothersill C., Seymour C.. Medium from irradiated human epithelial cells but not human fibroblasts reduces the clastogenic survival of unirradiated cells[J]. Int. J. Rad. Biol., 1997, 71: 421-427. DOI:10.1080/095530097144030 |
| [4] |
Gwyneth EW, Sally AL, Denise AM, et al. Chromosomal instability in unirradiated cells induced in vivo byabystander effect of ionizing radiation[J]. Cancer Reserch, 2000, 60: 5608-5611. |
| [5] |
Mothersill C, Seymour C. Cell-cell contact during gamma irradiation is required to induce a bystander effect in the normal human keratinocytes:evidence for release during irradiation of a signal controlling survival into the medium[J]. Radiat. Res., 1998, 149: 256-262. DOI:10.2307/3579958 |
| [6] |
Lorimore SA, Kadhim MA, Pocock DA, et al.Goodhead DT and Wright EG.Chromosomal instability in the descendants of unirradiated surviving cells after alpha-particle irradiation [J].Proc. Nat. Acad. 1998, 94: 8 010– 8 015.
|
| [7] |
Banath JP, Fushiki M, Olive PL. Rejoining of DNA single and doublestrand breads in human white blood cells exposed to ionizing radiation[J]. Int J Radiat Biol, 1998, 73: 649-660. DOI:10.1080/095530098141906 |
| [8] |
刘强, 姜恩海, 李进, 等. 单细胞凝胶电泳技术对离体和整体照射致细胞DNA断裂的一致性研究[J]. 中国辐射卫生, 2006, 15(2): 153-155. DOI:10.3969/j.issn.1004-714X.2006.02.012 |
| [9] |
Konca K, Lankoff A, Banasik A, et al. A cross-platform public domain PC image-analysis program for the comet assay[J]. Mutat Res, 2003, 534(1 -2): 15-20. |
| [10] |
Natarajan G, Kimio T, Nanao K. Comet assay to assess the mon-target effect of neutronradiation in human peripheral blood[J]. J. Radiat Res, 2001, 42: 157-163. DOI:10.1269/jrr.42.157 |





