线粒体是细胞产能的主要细胞器, 而线粒体内膜上的一组蛋白质与线粒体DNA基因组突变所致的各种疾病密切相关。细胞色素C氧化酶(Cytoehromec Oxidase, CcO)是线粒体内膜呼吸链上的终端酶, 主要参与ATP合成, 其功能异常往往导致某些能量代谢相关疾病的发生。上世纪90年代以来, 发现若干线粒体DNA突变与一些重大疾病, 特别是家族性神经退行性疾病如Parkinson's疾病、老年性痴呆、心肌衰退、糖尿病等密切相关[1]。近年来, 在肺癌、结肠癌、乳腺癌、胰腺癌、膀胱癌、头颈部肿瘤、胃癌、食管癌等多种肿瘤中发现了mtDNA的突变, 但是具体的作用机制尚不清楚[2]。
氡及其子体是人类受到天然辐射的主要来源, 已明确为Ⅰ类致癌物。在矿工中的研究认为100WLM即可使肺癌危险增加, 并与氡暴露量成直线关系[3]。氡及其子体进入呼吸道后, 结合态的氡子体主要沉积在肺部, 未结合的氡子体主要沉积在鼻咽部和气管-支气管区, 故从鼻咽部到细支气管、肺泡都可直接受到高传能线密度的α粒子照射[4]。关于氡的生物学效应及其机制的研究很少, 而氡暴露致肺病理损伤与CcO的关系尚未见报道。CcO是我们前期应用蛋白质组学方法筛选到的氡染毒后大鼠肺组织差异表达的蛋白质之一, 本研究通过观察肺的病理改变和测定肺组织线粒体中CcO的活性, 试图了解二者的相关性, 为进一步阐明氡致肺损伤的机制提供实验证据。
1 材料和方法 1.1 试剂和仪器线粒体提取试剂盒、细胞色素C氧化酶活性测定试剂盒(上海杰美)。多功能生态氡室(华东地质学院制造)。高速离心机(Beckman公司)。超声细胞粉碎机(宁波新芝生物科技股份有限公司)。Brastead超纯水装置(美国DUBUQUE)。紫外分光光度计(756MC)。捷达形态分析软件(江苏捷达)。
1.2 方法 1.2.1 实验动物及染毒条件健康雄性Wistar大鼠20只, 体重(150 ± 10)g, 由中科院上海动物中心提供(动物证号:中科动管会第001号)。随机分为正常对照组, 氡染毒组(低、中、高剂量组), 每组5只。氡染毒组大鼠整体暴露于多功能生态氡室, 通过计算机控制氡室内浓度, 保持恒定剂量率100 000 Bq/kL, 低、中、高剂量组染氡累积剂量分别达100、200、400WLM。正常对照组饲养于动物房内, 正常饮水和进食。
1.2.2 肺组织的分离染毒结束后用5%水合氯醛麻醉大鼠(1ml/100g), 开胸暴露气管和肺, 右肺结扎, 10%中性福尔马林固定, 作常规HE染色以及胶原纤维染色观察各组肺损伤程度。左肺气管灌洗和心脏灌洗以去除肺泡杂质和肺循环血液, 取同一部位组织进行线粒体提取。
1.2.3 肺组织病理观察和图像分析右肺作常规石蜡切片, HE染色观察各组肺大体情况, Masson胶原纤维染色观察各组肺组织纤维增生程度, 显微摄像。捷达形态分析系统软件对肺组织进行相对定量, 每个视野选取50个肺泡间隔厚度(相邻肺泡壁之间的直线距离)和100个肺泡, 计算每组的平均肺泡间隔厚度和平均肺泡面积。
1.2.4 线粒体提取及CcO活性的测定线粒体提取及CcO活性的测定按试剂盒说明进行。所有标本同批测定, 测定时称取肺组织100mg, 采用组织匀浆法及梯度离心法提取组织线粒体, 然后紫外可见分光光度计在550nm波长下, 分别测背景对照和各样品的吸光度, 加入组织匀浆液0.1ml, 立即开始计时, 60s读数-0s读数为样品吸光度值, 按公式(样品读数-背景读数)÷[(样品容量, ml)×(m mol尔吸光系数)] =单位/mL, 计算各样品中CcO的活性。
1.2.5 统计分析利用统计分析软件SAS8.1进行数据的方差分析和snk-q检验。
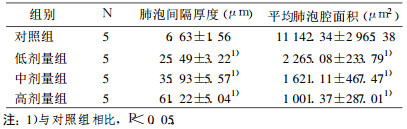
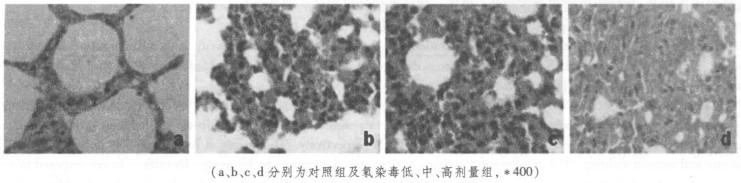
2 结果 2.1 肺组织病理改变肺组织常规HE染色结果及masson胶原纤维染色结果分别见图 1和图 2。由图中可见, 与正常对照组相比, 氡染毒组肺间质充血水肿, 肺泡间隔增厚, 炎症细胞浸润, 可见中性粒细胞, 淋巴细胞与巨噬细胞, 肺组织逐渐发生纤维化, 肺泡腔逐渐萎缩变小。软件分析结果显示肺泡间隔厚度由对照组的6.63μm逐渐增加到高剂量组的61.22 μm, 平均肺泡腔面积由对照组的11 142.34μm2逐渐减少到高剂量染毒组的1 001.37μm2(表 1)。
|
图 1 各组病理HE染色结果 |
|
图 2 Masson胶原纤维染色结果 |
|
|
表 1 肺组织病理半定量结果 |
对氡染毒低、中、高剂量组及对照组大鼠分别进行CcO活性的测定, 得到各组大鼠肺组织CcO的活性, 见表 2, 可见其活性随着氡染毒剂量的增加逐渐降低。
|
|
表 2 对照组与氡染毒组CcO活性 |
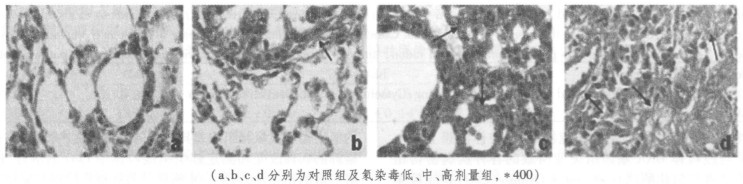
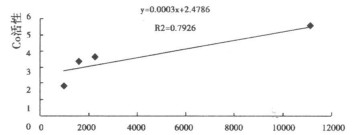
分别以肺泡隔厚度和肺泡腔面积为自变量, 分析CcO活性与它们的关系, 得出相关曲线如图 3和图 4。肺泡隔厚度和CcO活性呈负相关, R2值达0.969。肺泡腔面积和CcO活性呈正相关, 相关系数R2值为0.7926。CcO活性随肺泡间隔厚度的增加和肺泡腔面积的缩小而降低。
|
图 3 CcO活性与肺泡间隔厚度的关系 |
|
图 4 CcO活性与肺泡腔面积的关系 |
线粒体是细胞能量生成的重要细胞器, 也是细胞调节氧化应激的中枢。近年来的研究表明, 线粒体是活性氧ROS产生的主要场所, 同时也是ROS作用的重要靶部位。ROS一方面可以调节细胞的生理活动, 另一方面又可以对重要细胞器和分子造成氧化损害。ROS的作用方式与其浓度相关, nmol水平的ROS可促进细胞增值, μmol水平可导致细胞凋亡, 而mmol水平的ROS引起细胞的损伤死亡[5]。因此, 一旦ROS产生过多或细胞抗氧化能力下降, 线粒体就会受到ROS的氧化攻击。我们前期的研究表明, 氡及其子体吸入体内后, 可使体内活性氧水平明显增加, 进而使肺组织发生一系列病理改变[6]。氡染毒组中观察到的肺充血水肿, 肺泡间隔增厚, 炎症细胞浸润, 肺组织纤维化, 肺泡腔缩小萎缩等, 与放射性肺损伤病变相符[7], 可能与氡所致产生活性氧及机体的氧化损失等有关。
正常大鼠肺泡间隔仅可容纳单层上皮细胞, 厚度约6 ~ 8μm, 肺泡腔面积巨大。氡染毒后由于肺间质充血水肿, 炎症细胞浸润和纤维变性等, 致使肺泡间隔变厚, 肺泡腔萎缩变小。有研究表明, 巨噬细胞的吞噬能力与CcO的活性有关, 活性越高, 吞噬能力也越高[8]。氡及其子体作用于肺组织后, 由于ROS及炎症等的侵袭, 巨噬细胞吞噬能力达一定极限后开始下降, 炎症细胞逐渐增多, 因此肺泡间隔逐渐增厚, 增厚的肺间质进一步压缩肺泡腔, 使得肺泡腔逐渐萎缩消失。分析病理改变与CcO活性的相关性得出CcO活性与肺泡间隔厚度成负相关, 与肺泡腔面积成正相关, 其活性随着肺泡间隔厚度的增加和肺泡腔面积的缩小而逐渐降低。因此, CcO活性与肺泡间隔厚度和肺泡腔面积呈相关关系。
CcO是存在于细胞线粒体中的一种重要的呼吸酶, 利用脱氧胆酸(一种离子型去污剂)处理线粒体内膜, 可分离出呼吸链的4种复合物, 即复合物Ⅰ、Ⅱ、Ⅲ和Ⅳ, 分别为NADH脱氢酶、琥珀酸脱氢酶、细胞色素C还原酶和细胞色素C氧化酶(CcO)。CcO以二聚体形式存在, 每个单体由至少13条不同的肽链组成, 是真核生物线粒体内膜和需氧菌细胞膜电子传递链上的终端酶, 其作用是将细胞色素C接受的电子传给氧, 催化氧分子还原为水分子。CcO还有一种质子泵机制, 即在传递电子的同时, 每个反应循环中伴随着4个质子由膜内侧泵向外侧, 进而产生质子电化学梯度。生物体就是利用这种质子电化学梯度推动ATP合成的。ATP是许多生理过程所必需的的直接能源, 因此, CcO在生物体的代谢过程中至关重要。有报道表明, 放射病极期肺内巨噬细胞中CcO和琥珀酸脱氢酶活性下降, 之后恢复期又有上升(巨噬细胞之吞噬能力随酶活性升高而上升)[8]。本实验受照动物肺组织中CcO活性持续下降, 说明巨噬细胞吞噬能力下降, 肺部损伤严重。
总之, 本研究中, 氡及其子体染毒后大鼠肺组织中线粒体CcO活性持续降低, 而CcO是线粒体能量代谢中的一个关键的酶, 提示氡可使大鼠能量代谢发生障碍。线粒体又是细胞凋亡的一个重要的调控中心, 提示线粒体可能是氡的一个作用靶点, 氡可能通过线粒体细胞凋亡等途径对肺组织造成损害, 其具体途径及作用机理还有待进一步研究。
| [1] |
SIMON D K, JOHNS D R. Mitochondrial disorders:clinical and genetic features[J]. Annu Rev Med, 1999, 50: 111-127. DOI:10.1146/annurev.med.50.1.111 |
| [2] |
金雄杰, 张建军, 宋燕, 等. 肺癌线粒体DNA突变的研究[J]. 癌症, 2002, 21(7): 715-718. |
| [3] |
LUBIN J. Lung cancer in radon-exposed miners and estimation of risk from indoor exposure[J]. Natl Cancer Inst, 1995, 87: 817-827. DOI:10.1093/jnci/87.11.817 |
| [4] |
HELLMAN B, FRⅡS L, VAGHEF H, et al. Alkaline single cell gel electrophoresis and humcm biomonitoring for genotoxicity; Astudy on subjects with residential exposure to radon[J]. Mutation Research, 1999, 442(2): 121-132. DOI:10.1016/S1383-5718(99)00083-2 |
| [5] |
HANI Atamna, WILLIAM H.FREY Ⅱ. Mechanisms of mitochondrial dysfunction and energy deficiency in Alzheimer's disease[J]. Mitochondrion, 2007, 7(5): 297-310. DOI:10.1016/j.mito.2007.06.001 |
| [6] |
仲恒高, 苗超, 臧黎慧, 等. 氡及其子体吸入对大鼠肺与血细胞的氧化应激损伤[J]. 苏州大学学报(医学版), 2005, 25(5): 765-767. |
| [7] |
LEHNERT B E, DETHLOFF L A, FINKELSTEIN J N, et al. Temporal sequence of early alterations in rat lung following thoracic X-irradiation[J]. Int J Radiat Biol, 1991, 60(4): 657-675. |
| [8] |
郭鹞, 王克为, 王子灿, 等. 放射损伤病理学[M]. 北京: 人民卫生出版社, 1987: 239-243.
|