2. 中国医学科学院中国协和医科大学放射医学研究所分子核医学重点实验室, 天津 300192
原发性肝癌是我国高发的恶性肿瘤之一, 近年来立体适形放疗的实践证实, 肝癌对射线有相当高的反应率[1]。Rb基因是最早被发现的抑癌基因, 它的缺失或突变与很多肿瘤的发生有关。有研究表明, Rb基因的改变在肝癌的发生发展中起着一定作用[2]。Rb94基因是Rb基因的一部分(野生型全长pRb110的NH2末端缺失112个氨基酸残基), 本研究应用重组腺病毒Ad-Rb94基因感染人肝癌细胞系HepG2, 进行X射线照射, 观察Ad-Rb94基因联合放疗对肝癌细胞生长的影响, 探讨其联合抑瘤作用。
1 材料和方法 1.1 材料 1.1.1 细胞系、培养条件及照射条件人肝癌细胞系HepG2由中国医学科学院放射医学研究所提供。人胚肾293细胞由天津医科大学微生物教研室惠赠。Varian600C直线加速器6MV-X射线等中心照射, 射野大小为10cm×10cm, 剂量率320cGy/min, 照射时培养板上放置1.5cm厚的有机玻璃板。
1.1.2 试剂DMEM培养基、RPMI1640培养基购自GIBCO公司, 新生小牛血清为杭州四季青生物工程材料有限公司产品, 重组腺病毒介导的Rb94基因(Ad-Rb94)及对照腺病毒Ad-lacZ由中国医学科学院放射医学研究所构建保存。MTT为Amressco公司产品, 分析纯DMSO(二甲基亚砜)为上海生工生物工程公司产品。
1.1.3 主要仪器设备Varian2100C直线加速器(美国); 酶标仪(Thermo, 美国); 流式细胞仪(Beckman Altra Ⅱ, 美国)。
1.2 方法 1.2.1 细胞培养人胚肾293细胞用含10 ℅小牛血清的DMEM培养基, 人肝癌HepG2细胞用含10℅小牛血清的RPMI 1640培养基, 置5%CO2、饱和湿度、37℃培养箱中培养。
1.2.2 重组腺病毒颗粒的制备利用已构建好的重组腺病毒Ad-Rb94和Ad-lacZ, 方法见文献[3], 转染人胚肾293细胞制备粗腺病毒溶胞产物, 然后扩增高滴度的腺病毒颗粒。
1.2.3 实验分组分组设计为空白对照组、Ad-LacZ对照组、Ad-Rb94组、放疗组(吸收剂量为400cGy)和Ad-Rb94联合放疗组(加入Ad-Rb94后6h进行400cGyX射线照射)。
1.2.4 MTT比色法取对数生长期的HepG2细胞按5×103个/孔接种于96孔培养板, 每孔加20μlAd-Rb94(病毒滴度为1.6×108 pfu/ml), 每组设4个复孔。培养24、48、72、96h后加入0.5% MTT液20μl, 孵育4h后酶标仪测定492nm吸光度(OD值)。绘制细胞生长曲线图并计算细胞生长的抑制率:抑制率=(1-实验组OD值/对照组OD值)×100%。
1.2.5 流式细胞术检测细胞周期及凋亡率取对数生长期的HepG2细胞按2×105个细胞/孔接种于6孔培养板, 每孔加200μlAd-Rb94(病毒滴度为1.6×108 pfu/ml), 每组设2孔。培养24h后收集所有悬浮及贴壁细胞, 每组各取一孔用冷PBS液洗涤2次, 75%冰乙醇固定1h, -20℃保存。检测前用冷PBS液洗2次后加入500μl碘化丙啶, 轻轻混匀, 暗处避光反应30min, 上流式细胞仪488nm波长检测细胞周期。每组各取另一孔, 用冷PBS液洗3次, 弃上清后加入10μlAnnexin V-FITC和500μlPI, 轻轻混匀, 避光室温反应15min, 上流式细胞仪488nm检测细胞凋亡率。
1.3 统计学分析采用SPSS13.0软件包进行统计分析, 显著性检验采用单因素方差分析及q检验, P<0.05表示差异有统计学意义。
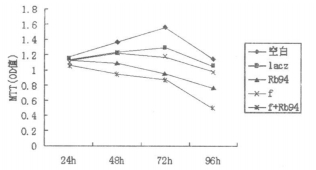
2 结果 2.1 Ad-Rb94联合放疗对肝癌HepG2细胞生长的抑制曲线从生长曲线看出, 空白对照组和Ad-lacZ组HepG2细胞数量随培养时间延长呈增加的趋势, 而Ad-Rb94基因组、放疗组和Ad-Rb94基因联合放疗组HepG2细胞的生长均受到抑制, 尤其在转染后96h细胞存活数量最低, 与Ad-lacZ组和空白对照组比较差异均有统计学意义(P<0.05), 而Ad-lacZ组和空白对照组差异无统计学意义(P>0.05), 见图 1。其中联合治疗组HepG2细胞生长最为缓慢, 与基因组和放疗组比较差异均有统计学意义(P<0.05)。
|
图 1 Ad-Rb94联合放疗作用于HepG2细胞的生长抑制曲线(f指放疗) |
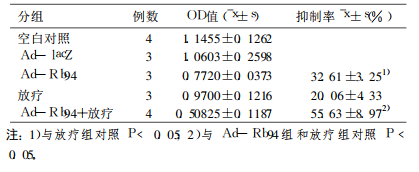
Rb94基因转染HepG2细胞后96h, Ad-Rb94组HepG2细胞生长抑制率与放疗组比较有明显差异(P<0.05), 而Ad -Rb94联合放疗组的抑制作用均明显高于Ad-Rb94组和放疗组(P<0.05), 见表 1。结果提示Rb94基因对HepG2细胞的生长具有抑制作用, 而Rb94基因与放射治疗联合应用具有协同效应, 能更有效地抑制肿瘤细胞的生长。
|
|
表 1 Ad-Rb9联合放疗对HepG2细胞生长的抑制效应 |
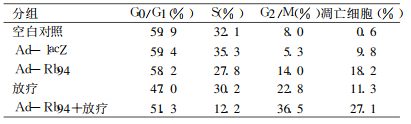
从流式分析结果可见, 与空白对照组及Ad-lacZ组相比, Ad-Rb94组、放疗组及Ad-Rb94联合放疗组HepG2停留在G2/M期的细胞增加, G0/G1期和S期细胞数量减少, 凋亡细胞数量增加。其中以联合治疗组G2/M期细胞和凋亡细胞所占比例最高, 分别达到36.5%和27.1%, 见表 2。结果表明AdRb94联合放疗使HepG2细胞主要阻滞在G2/M期, 促进细胞发生凋亡。
|
|
表 2 Ad-Rb94联合放疗后HepG2细胞的细胞周期及凋亡 |
全长Rb基因有调控细胞周期, 抑制肿瘤细胞增殖, 促进肿瘤细胞分化的作用。pRb94是N端截短的Rb蛋白, 不仅具有全长Rb基因的功能, 而且因其半衰期长, 比野生型Rb蛋白的抑瘤作用更强。腺病毒介导的Ad-Rb94基因转染头颈部鳞癌[4]、膀胱癌[5]、胰腺癌[6]等细胞株, 可导致细胞株转基因表达, 细胞生长抑制和细胞凋亡。
放疗联合基因治疗是传统治疗方式与最新生物治疗技术相结合的产物。放射使受照细胞表面受损及穿孔, 引起细胞膜通透性和跨膜电位的改变, 便于带负电荷的外源基因主动进入细胞, 提高基因转移的效率[7]。基因治疗可干扰辐射诱发DNA损伤修复, 增强DNA对辐射损伤的敏感性[8], 两者联合具有协同作用。
为了确定腺病毒表达载体上基因的作用, 本研究以重组腺病毒Ad-lacZ作为对照, 我们发现Ad-lacZ本身对肝癌细胞的生长没有抑制作用, 表明对肿瘤细胞的抑制作用来自转导的Rb94基因, 而不是复制缺陷病毒载体本身。
本实验结果表明Ad-Rb94、放疗、Ad-Rb94联合放疗对肝癌细胞的生长均有一定的抑制效果, 其中以Ad-Rb94联合放疗的抑制肿瘤细胞生长作用最强, 这与相关文献的报道一致[3]。有报道称人肝癌细胞系HepG2对X射线有较高的放射敏感性, 并且小剂量(<10Gy)照射后细胞周期G2监测点被激活, 细胞凋亡特异性发生在G2期[9, 10]。本研究也证实了这一结果, Ad-Rb94联合放疗后HepG2细胞阻滞于G2-M期的细胞数最多, 凋亡细胞最高, 表明肿瘤细胞的DNA合成受到了抑制, 从而影响肿瘤细胞的分裂和增生。肿瘤细胞阻滞在G2期时对放疗比较敏感, 从而提高肿瘤细胞对放疗的敏感性。本实验结果表明了Rb94基因与放射治疗联合应用具有相加和协同效应, 有效的抑制肿瘤细胞的异常增生。本研究为肝癌的基因治疗联合放疗研究以及可能的临床应用提供了理论基础和实验依据。
| [1] |
朱小杨. 立体适形放疗在原发性肝癌中的应用进展[J]. 中华现代内科学杂志, 2006, 3(9): 1002-1004. |
| [2] |
ROTCHELL J M, ULNAL E, VAN BENEDEN R J, et al. Retinoblastoma gene mutations in chemically induced liver tumor samples of Japanese medaka (Oryzias latipes)[J]. Mar Biotechnol, 2001, 3(Supplement 1): 44-49. |
| [3] |
赵艳芝, 王芹, 李进, 等. 人Rb94基因联合γ-辐射抑制乳腺癌细胞生长的研究[J]. 中国辐射卫生, 2007, 16(3): 277-279. DOI:10.3969/j.issn.1004-714X.2007.03.009 |
| [4] |
LI D, DAY K V, YU S, et al. The role of adenovirus mediated retinoblastoma 94 in the treatment of head and neck cancer[J]. Cancer Res, 2002, 62(16): 4637-4644. |
| [5] |
ZHANG X, MULTANI A S, ZHOU J H, et al. Adenoviral-mediated retinoblastoma 94 produces rapid telomere erosion, Chromosomal crisis, and caspase-dependent apoptosis in bladder cancer and immortalized human urothelial cells but not in normal urothelial cells[J]. Cancer Research, 2003, 63(4): 760-765. |
| [6] |
ROIG J M, MOUNA M A, CASCANTE A, et al. Adenovirus-mediated retinoblastoma 94 gene transfer induces human pancreatic tumor regression in a mouse xenograft model[J]. Clinical Cancer Research, 2004, 10(4): 1456-1460. |
| [7] |
JAIN P T, GEWIRTZ D A. Sustained enhancement of liposome —mediated gene deliver and gene expression in human breast tumor cells by ionizing radiation[J]. Int J Radiat Biol, 1999, 75(2): 217-223. DOI:10.1080/095530099140672 |
| [8] |
TEH B S, AGUKLAR-Cordova E, VLACHAKI M T, et al. Combining radiotherapy with gene therapy (from the bench to the bedside): A novel treatment strategy for prostate cancer[J]. The Oncologist, 2002, 7(5): 458-466. DOI:10.1634/theoncologist.7-5-458 |
| [9] |
石卫民, 范义湘, 陈龙华, 等. 两株人肝癌细胞QSG-7701和HepG2放射敏感性的体外研究[J]. 癌症, 2002, 21(9): 1020-1021. |
| [10] |
谢大兴, 冯永东, 张鹏, 等. 不同剂量X射线对细胞周期监测点和细胞凋亡的影响[J]. 中华实验外科杂志, 2005, 22(7): 798-800. DOI:10.3760/j.issn:1001-9030.2005.07.012 |