原发性甲状旁腺机能亢进(甲旁亢HPT)是一种常见的内分泌疾病, 每年的发病率达0.2~0.5/1 000人[1]。对于一个有经验的外科医师来说, 通过颈部探查切除甲状旁腺腺瘤是可能的, 但反复颈部探查往往会产生很高的喉返神经麻痹和甲状旁腺机能减退等并发症。因而术前的精确定位对于缩小外科创伤和降低手术失败率(特别是异位腺瘤)是极为重要的[2, 3]。我们自2002年6月至2007年3月应用99mTc-MIBI对21例原发性甲旁亢进行术前定位和定量分析。现报道如下。
1 资料和方法 1.1 对象21例临床诊断原发性甲旁亢需要进一步明确诊断及术前定位者。其中女15例, 男6例。年龄17~68岁(平均46.9岁)。均经手术及病理证实。每个患者术前测血清甲状旁腺激素(PTH)及血清钙。
1.2 显像及结果解释所有病人在术前一周左右接受99mTcMIBI显像。静脉注射99mTc-MIBI740MBq后分别于10min和120min作颈、胸部前位显像。采用大视野SimenseDiacamVAX -330 SPECT或PHILIPSSKYlight双探头SPECT, 装备高分辨率低能平行孔准直器。MIBI药盒由江苏省原子医学研究所提供。常规采用前位平面显像, 必要时加斜位和侧位。对99mTcMIBI平面显像阴性而有临床甲旁亢依据者行SPECT断层显像, 采集360°, 每帧5.6°, 共64帧, 每个层面采集30s, 采集128 ×128矩阵。用Butterworth滤波重建图象, 获得横断、矢状、冠状面图像, 每个层面厚8.64mm。在早期(10min)或延迟(120min)99mTc-MIBI显像上出现灶性放射性摄取高于甲状腺组织可考虑为阳性异常甲状旁腺组织。
1.3 定量分析在病变的甲状旁腺和甲状腺放射性最高部位由计算机构划等同大小的感兴趣区(ROI), 按各感兴趣区的平均计数计算比值, 即P/M (P为甲状旁腺、M为甲状腺放射性最高部位)。在病变的甲状旁腺(T)和相应对侧部位(NT)由计算机构划等同大小的感兴趣区(ROI), 计算T/NT比值。
1.4 统计处理统计比较采用平均数和标准差表示(x±S)。t检验, P < 0.05为统计学差异。
2 结果21例原发性甲旁亢病例中, 病灶位于正常位置(甲状腺左、右叶上下极背侧)16例; 异常位置5例(其中甲状腺下界延伸至胸骨后3例、胸骨后2例)。平面双时相显像阳性17例; 其敏感性为81%(17/21);4例平面显像阴性者经SPECT断层显像2例证实为阳性(其中1例位胸骨后, 重0.48g, T/NT为1.35;1例腺瘤位正常位置同时病人患多发结节性甲状腺肿, 重0.71g, T/NT为1.27)。显像定位与手术位置一致。2例假阴性者(腺瘤位置正常, 瘤体重和靶甲状旁腺腺瘤/非靶比值(T/ NT)分别为:1.61g、1.14g和1.05、0.98。
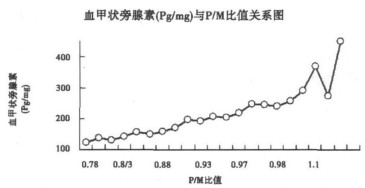
甲状旁腺腺体的大小和T/NT比值影响平面显像的主要因素; 而瘤体大小对SPECT断层探测的影响不大; 这主要与仪器的探测效率有关。而腺体的大小与腺体的摄取率无明显关联。在本组研究中, 2例平面和SPECT断层均为假阴性者, 其腺体的大小应在可探测之范围内, 但T/NT比值较低而被漏诊。甲状旁腺腺瘤在延迟显像时(120min)放射性滞留增加者仅占70%(12/17);而其他腺瘤洗出较快。P/M的平均摄取率为0.95 ±0.41。平面显像阳性显像者T/NT比值为2.5 ±1.76。统计学分析提示P/M比率与术前PTH水平有明显关联(P < 0.05)见图 1;而甲状旁腺腺瘤的摄取率与其他血生化无关。T/NT比值在阳性组与SPECT显象假阴性者间差异有显著性(P < 0.001)

|
图 1 甲状腺显像 ①99mTc甲状腺显象, 大小位置正常。②99mTc-MIBI显像(10mim), 相当于甲状腺左下极见一异常浓聚。③99mTc-MIBI显像(120mim), 甲状腺内放射性消退, 甲状腺左下极(甲旁腺腺瘤)异常浓聚持续。④ SPECT断层(冠状面) T/NT比值为3.929。 |
|
图 2 血甲状旁腺素(Pg/mg)与P/M比值关系 |
原发性甲旁亢最常见的原因(80%-85%)为单个甲状旁腺腺瘤所致。对于一个有经验的外科医师来说, 通过双侧颈部探查切除原发性甲状旁腺腺瘤的成功率可达90%~95%[4]; 但双侧颈部探查易导致喉返神经损伤和甲状旁腺机能减退等并发症发生率明显增加。事实上, 只有在怀疑为甲状旁腺增生或双侧甲状旁腺腺瘤时才考虑作双颈部手术探查。在甲状腺正常或异位性甲状旁腺腺瘤的病人采用99mTc-MIBI术前定位或术中γ-探针技术能减少外科创伤, 是最为可靠和实用的。据报道[5], 异位性甲状旁腺腺瘤的发生率高达20%;这是导致外科手术失败的主要原因之一。99mTc-MIBI甲旁亢腺瘤定位可指导外科医师的精确探查; 应用γ探针技术能对手术信息即时反馈。
99mTc-MIBI双时相甲状旁腺显像被用于术前原发性甲状旁腺腺瘤精确定位的主要原理是MIBI为单价、亲脂带正电荷, 易通过细胞膜被动扩散进入胞内, 并高度浓聚在线粒体内。而高活性的甲状旁腺细胞内含有丰富的线粒体(特别是其中的嗜氧细胞)、代谢率高和血供丰富[6], 促使MIBI在胞内浓聚明显增加。而且, 发现高活性的甲状旁细胞对MIBI从细胞中洗出比正常甲状旁腺细胞和甲状腺细胞更慢[7]。这就是99mTc-MIBI甲旁亢延迟显像获得成功的基本机制。但是, 在某些腺瘤, 少量嗜氧细胞可引起99mTc-MIBI快速从甲状旁腺腺瘤中洗出; 这样, 当99mTc-MIBI在甲状旁腺腺瘤中的洗出率接近甲状腺细胞时, 会使99mTc-MIBI延迟显像失去诊断意义[6]。我们的研究发现, 仅有70%(12/17)的甲旁亢在延迟显像时, 腺瘤中有明显放射性滞留。如果采用早期SPECT断层比延迟显像更有效、阳性检测率更高。有报道[1]不提倡延迟SPECT断层的主要理由也是因为少数病例可能因快速洗出而致假阴性诊断。
99mTc-MIBI甲状旁腺平面显像不足在于存在一定的假阴性, 特别是病灶 < 0.5g时。本组病例中, 二例平面显像假阴性而SPECT断层阳性的病灶分别为0.48g和0.71g。病灶大小虽然可影响平面显象的阳性率, 如果同时采用SPECT断层可以弥补其不足。但即使病灶有足够大小, T/NT的比值低也可直接影响阳性诊断; 本组病例中2例假阴性者病灶大小分别为1.61 g和1.14g, 而T/NT仅为1.05和0.98。当同时存在亲MIBI的甲状腺结节时, 双时相平面显像有可能将甲状腺结节放射性误认为甲状旁腺损伤, 而造成假阳性结果[9]。同时, 甲状腺异常(特别是多发结节性甲状腺肿MNG)可降低甲旁亢平面显像的敏感性。本研究中, 4例平面显像假阴性者中有1例是因同时存在MNG所致, 占假阴性的25%(1/4)。其主要原因是甲状旁腺腺瘤主要存在于甲状腺后面, 甲状腺结节对99mTc-MIBI浓聚程度差异很大, 对临近的甲状旁腺必然会产生一定的干扰。而且MNG可占甲状腺疾病的31%[10]。但采用SPECT断层显像, 即使同时存在MNG也不会影响对甲旁亢的诊断敏感性。也有文献[8]报道, 对于再次手术或复发的甲旁亢患者、异位性甲状旁腺腺瘤, 采用99mTc-MIBISPECT断层显像定位较平面显像更为有效。我们的结果显示, 临床上高度怀疑甲旁亢, 而平面显像阴性者, 应作SPECT断层。它可对深部、异位性甲状旁腺腺瘤和同时存在MNG干扰的情况下提供精确的三维显像资料。
有报道[11]99mTc-MIBI在甲旁亢的摄取与病人血清PTH的水平相关。我们应用定量分析的结果也提示, P/M比值与术前血清PTH激素水平呈正比关系。尽管这二者之间的精确机制尚不十分清楚, 但嗜氧细胞浓聚和滞留MIBI在这一过程中起着重要作用; 甲状旁腺腺瘤对MIBI的摄取与富线粒体的嗜氧细胞数量有关[12]。另外, 作为甲状旁腺的主体细胞, 嗜氧细胞分泌PTH; 而且在导致甲旁亢的病理生理过程中, 其在甲状旁腺中的数量明显增加[13]。根据这一结果, 凡是术前血清PTH水平高的患者, 提示最佳的外科治疗方法是采用γ-探针放射性引导手术。
4 结论99mTc-MIBI显像是最有效的探测甲状旁腺腺瘤的方法; 甲状旁腺腺瘤对MIBI的摄取与术前血清PTH激素水平呈正相关; 当甲状旁腺腺瘤位置较深、体积较小、异位或同时存在MNG干扰的情况下, 99mTc-MIBISPECT断层的敏感性比平面显像更高。
| [1] |
LORBERBOYM M, MINSK Ⅱ, MACADZIOB S, et al. Incremental diagnostic value of preoperative 99mTc-MIBI SPECT in patients with a parathyroid adenoma[J]. J Nucl Med, 2003, 44: 904-908. |
| [2] |
HOWE J R.MINIMALLYI. NVASIVE. parathyroid surgery[J]. Surg ClinNorth Am, 2008, 80: 1399-1426. |
| [3] |
INABNETW B, FULLAY, RICHARDB, et al. Unilateral neck exploration under local anesthesia:the approach of choice for asymptomatic primary hyperpara thyroidism[J]. Surgery, 1999, 126: 1004-1009. DOI:10.1067/msy.2099.101834 |
| [4] |
RUBELLO D, PIOTTO A, PAGETTA C, et al. Ectopic parathyroid adenomas located at carotid bifurcation:the role of preoperative Tc-99m-MIBI scintigraphy and the intraoperative gamma probe procedure in surgical treatment planning[J]. Clin Nucl Med, 2000, 26: 774-776. |
| [5] |
ROTHMUND M, DIETHELM H, BRUNNER H, et al. Diagnosis and surgical treatment of mediastinal parathyroid tumors[J]. Ann Surg, 1976, 183: 139-145. DOI:10.1097/00000658-197602000-00010 |
| [6] |
STAUDENHERZ A, NIEDERLE B, ABELA C, et al. Comparison and histopathological correlation of three parathyroid imaging methods in apopulation with a high prevalence of concomitant thyroid diseases[J]. Eur J Nucl Med, 1997, 24: 143-149. DOI:10.1007/BF02439546 |
| [7] |
ODOHERTY M J, KETTLE A G, WELLS P, et al. Parathyroid imaging with technetium-99m-sestamibi:preoperative localization and tissue uptake studies[J]. J Nucl Med, 1992, 33: 313-316. |
| [8] |
BILLOTEY C, SARFATI E, ARENGO A, et al. Advantages of SPECT in 99Tcm-sestamibi parathyroid scintigraphy[J]. J Nucl Med, 1996, 37: 1773-1778. |
| [9] |
TAILLEFER R, BOUCHER Y, POTVIN C, et al. Detection and localization of parathyroid adenom as in patients with hyperpara thyroidism using a single radionuclide imaging procedure with technetium-99m-sestamibi (double-phase study)[J]. J Nucl Med, 1992, 33: 1801-1807. |
| [10] |
CASARA D, RUBELLO D, PIOTTO A, e tal. 99mTc-MIBIradio-guided minimally invasive parathyroid surgery planned on the basis of apreoperative combined 99mTcpertech netate/99mTc-MIBI and ultrasound imaging protocol[J]. Eur J Nucl Med, 2000, 27: 1300-1304. DOI:10.1007/s002590000297 |
| [11] |
HUNG G U, WANG S J, lIN W Y. Tc-99mMIBI parathyroid scintigraphy and intact parathy roid hormone levels in hyparathy roidism[J]. Clin Nucl Med, 2003, 28: 180-185. |
| [12] |
MELLOUL M, PAZ A, KOREN P, et al.99mTc-MIBI scintigraphy of parathyroid adenomas and relation to tumor size and oxyphil cell abundance[J].2001, 28: 209-214.
|
| [13] |
ALLENT B, THORBUMK M. The oxyphil cell in abnormal parathyroid glands.A study of 114 cases[J]. Arch Pathol Lab Med, 1981, 105: 421-424. |


