Rb基因(人类视网膜母细胞瘤基因)是上世纪80年代中期克隆出来的第一个人类肿瘤抑制基因[1], 位于13号染色体q14部位, 分子量为110kDa (pRb110), Rb基因的缺失和突变将引起细胞无限生长和繁殖, 进而导致肿瘤的发生。Rb94基因是Rb基因的一部分(野生型全长pRb110的NH2末端缺失112个氨基酸残基)。最近有少量研究发现Rb94具有比Rb更强的肿瘤抑制效应, 其蛋白在Rb-/-肿瘤细胞中的半衰期为12h, 比Rb110长3倍, 腺病毒介导的Rb94基因转染头颈部癌[2]、膀胱癌[3]及前列腺癌[4]细胞系及体内肿瘤具有明显的肿瘤抑制效应。肿瘤基因-放疗是近年来提出的肿瘤治疗新思路, 从机制上讲基因治疗和放疗两者具有协同作用, 可共同抑制肿瘤细胞的生长。笔者通过腺病毒介导, 将Rb94基因转入到乳腺癌细胞中, 再联合γ-辐射进行体外实验, 探讨其协同作用, 为乳腺癌临床治疗的应用提供实验和理论基础。
1 材料与方法 1.1 主要试剂TRIzol reagent, Thermo ScriptTM RT、Platinum® Taq DNA Polymerase High Fidelity、T4 DNA Ligase、Gateway® LR ClonaseTM Enzyme Mix、载体pENTRTM 1A、表达载体pAd/CMV/V5-DESTTM均为Invitrogen公司产品。EcoRⅤ、XmnⅠ、MsⅡ、NheⅠ为BioLabs公司产品。UltraPureTM PCR产物纯化试剂盒为北京赛百盛基因技术有限公司产品。A型超纯质粒大量快速提取试剂盒为北京博大泰克公司产品。高感受态TOP10细菌为北京博大泰克公司产品。
1.2 基因特异引物上海生工生物技术公司合成引物用于扩增全长Rb94基因编码序列。上游引物:5’-ATG TCG TTC ACT TTA CTG AGC TAC- 3’, 下游引物:5’-GGT TAT CAG GAC TCC CAC TCT A -3’。
1.3 细胞株乳腺癌(MCF-7)细胞为放射所提供。
1.4 主要仪器PCR扩增仪(Thermo, 美国); 电泳图像处理系统(Bio-Rad); 137Cs γ射线照射源(USD, 加拿大); 酶标仪(Thermo)。
1.5 含Rb94基因的重组腺病毒表达载体的构建 1.5.1 人胚胎组织总RNA的提取及逆转录用TRIZOL试剂按说明书进行操作。用紫外分光光度计鉴定RNA纯度和浓度。
1.5.2 逆转录-PCR扩增用基因特异引物做逆转录, 得到cDNA的第一条链。在离心管中加入5μl 10×高保真PCR缓冲液、1μl 10mM dNTP、2μl 50mM MgSO4、各1μl引物(10μM)、1μl模板DNA、0.3μl Platinum Taq High Fidelity、高压双蒸水标定到50μl。94℃预变性2min, 然后进入循环94℃变性30s, 58℃退火30s, 68℃延伸3.5min, 共30个循环, 最后68℃10min。电泳观察目的条带。
1.5.3 目的片段和载体pENTRTM1A的连接先把载体pENTRTM1A进行平末端酶切(10×NEB缓冲液Ⅱ 5μl、100×BSA 0.5μl、Xmn I 0.8μl、EcoR Ⅴ 1.2μl、质粒1μg、双蒸水定容至50μl, 37℃过夜)。然后把酶切后的载体pENTRTM 1A与目的基因按DNA连接酶试剂盒说明书操作连接起来, 再转化入TOP10大肠杆菌进行选择扩增。用质粒提取试剂盒提取含目的片段的质粒, 做电泳观察。并在Rb94基因和pENTRTM 1A上分别选一单一酶切位点进行MsⅡ、NheⅠ酶切鉴定连接方向
1.5.4 重组腺病毒表达载体的构建通过LR重组技术把介入载体和腺病毒表达载体按腺病毒表达质粒的说明书进行操作, 从而构建表达载体。然后转化入TOP10大肠杆菌进行扩增, 用质粒提取试剂盒提取含目的基因的腺病毒表达载体, 用特异引物做目的片段PCR, 电泳鉴定, 并进行测序。
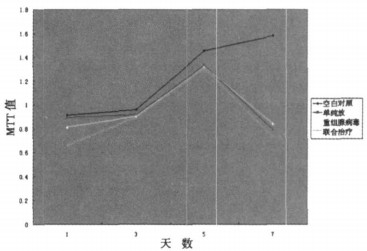
1.6 体外实验转染前一天用胰酶消化肿瘤细胞并计数, 用96孔板, 以每孔103~104个肿瘤细胞、体积200μl放入板中, 培养24h, 待细胞生长良好时按以下方法分组处理①单纯基因治疗组, 每孔加入含Rb94基因的重组腺病毒100μl (1.6×108pfu/ml); ②单纯放疗组:每孔用137Cs γ射线照射源2Gy进行照射; ③联合治疗组:每孔加入含Rb94基因的重组腺病毒100μl (1.6×10-8pfu/ml), 转染6h后再用137Cs γ射线照射源2Gy进行照射④设空白对照组不做任何处理。每一组内做4个复孔。然后37℃、5%CO2培养箱内静置培养。每组分别于处理完后第一天、第三天、第五天、第七天用MTT法测其在490nm波长下的吸光值, 绘制生长曲线。
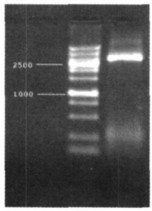
2 结果 2.1 Rb94基因PCR电泳结果所要扩增的Rb94基因的长度为2 774bp, 用特异引物扩增所得的条带经电泳鉴定所得结果与预期一致, 如图 1。
|
图 1 Rb94基因PCR电泳图 |
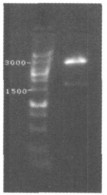
从图 2可以看到用MsⅡ、NheⅠ酶切后得到了预期的2 933bp和2 086bp两条酶切片段, 证明连接方向正确。见图 2。
|
图 2 构建的含目的基因的pENTRTM1A载体酶切鉴定电泳 |
重组腺病毒表达载体构建完成后, 以腺病毒表达载体为模板, 用特异引物做PCR, 电泳验证含有目的基因, 见图 3。

|
图 3 重组腺病毒表达载体的PCR鉴定电泳 1、2道为不含目的基因的空腺病毒载体为模板3、4道为含目的基因的重组腺病毒载体为模板 |
重组腺病毒转染乳腺癌细胞后, 用特异引物以乳腺癌细胞DNA和转染后的提取的DNA为底物做PCR, 可以看到未转染重组腺病毒的乳腺癌细胞中没有扩增得到Rb94片段, 而转染了重组腺病毒的乳腺癌细胞中扩增得到了相应的Rb94基因片段, 证明我们用重组腺病毒转染成功。

|
图 4 转染乳腺癌细胞后PCR电泳图 1道是未转染重组腺病毒乳腺癌细胞2道是转染重组腺病毒后乳腺癌细胞 |
|
图 5 联合治疗后乳腺癌细胞生长曲线图 |
可以看到联合治疗组的曲线比单纯放疗组、单纯重组腺病毒组及空白组位置都要低, 说明联合治疗组的效果要比单一的治疗效果好。单纯放疗组和单纯重组腺病毒组两者之间没差别。
3 讨论我们是从人类的胚胎组织中进行Rb94基因的扩增, Rb94基因片段在人类基因中属于低丰度的基因并且相对较长, 为了保证所扩增片段的准确复制, 我们选用了美国INVITROGEN公司的高保真聚合酶, 在少量基因存在的情况下也能很好的复制并且尽量避免错配的发生, 保证了我们所扩增片段的含量和准确性。对pENTR1A进行处理时用的是Xmn I和EcoR Ⅴ这两个平末端限制性内切酶, 酶切后的片段为平末端。高保真聚合酶扩增的Rb94片段也是平末端。两个片段平末端连接涉及到了连接方向的问题, Rb94基因如果反方向连接则形不成正确的Kozak序列(此序列的存在能保证在表达载体及肿瘤细胞中目的基因的正确的翻译表达蛋白), 所以我们在Rb94基因和pENTR1A两个片段上分别选取了单一的酶切位点MslⅠ和NehⅠ进行酶切鉴定连接方向。成功构建pENTR1A质粒后, 经过酶切鉴定, 我们所构建的质粒连接方向是正确。LR重组技术把目的Rb94基因重组到腺病毒表达载体时, 基因的插入方向不变, 不影响Kozak序列的存在。本实验中采用的载体构建方法及材料与国外已经构建的含Rb94基因的载体的构建方法及材料都不同[2], 可以用于进一步研究确定其功能, 并为Rb94基因药物研制奠定了基础。
放疗是目前肿瘤治疗的主要方法, 从机理上分析, 放疗和基因治疗两者之间存在着相互增强的作用。放射使受照细胞表面受损及穿孔, 引起细胞膜通透性和跨膜电位的改变, 便于带负电荷的外源Rb94 DNA主动进入细胞[5, 6]。辐射能促进病毒载体的第2条链的合成来提示辐射能促进病毒的复制, 而Rb94基因是通过腺病毒载体来转染肿瘤细胞的, 从而辐射也促进治疗基因在肿瘤细胞中的含量, 进而提高表达量, 也就说放疗可以加强基因治疗[7]。同时有研究指出基因治疗使肿瘤细胞阻滞于G1期, 减少了进入S期的细胞, 而G1后期对放疗比较敏感, 从而提高肿瘤细胞对放疗的敏感性[8]。基因治疗也可干扰辐射诱发DNA损伤修复, 增强DNA对辐射损伤的敏感性[9]。这在Rb94基因作用机理的实验中进一步得到了印证(文章待发表)。从理论上讲放疗和基因治疗两者相互加强, 可以取得比单一方法效果更好的抑瘤效果。从本实验的研究结果可以得知转染Rb94基因联合γ-辐射作用于乳腺癌细胞后的效果要比单纯的Rb94基因治疗、单纯的放疗效果要好, 单纯的Rb94基因治疗组和单纯的放疗组两者之间没有明显的差别。
| [1] |
LEE WEN-HWA, ROBERTBOOKSTEIN, FRANK HOMG, et al. Human retinoblastoma susceptibility gene:Cloning, I-dentification, and sequence[J]. Science, 1987, 235: 1394-1399. DOI:10.1126/science.3823889 |
| [2] |
DAQING LI, KATHERINE V. DAY, SHUAHEN YU, et al. The role of adenovirus-mediated retinoblastoma 94 in thetreatment of head and neck cancer[J]. Cancer Research, 2002, 62: 4637-4644. |
| [3] |
ZHANG XINQIAO, ASHA S MULTANI, JAIN-HUAZHOU, et al. Adenoviral-mediated retinoblastoma 94 pro-duces rapid telomere erosion, Chromosomal crisis, andcaspase-dependent apoptosis in bladder cancer and immor-talized human urothelial cells but not in normal urothelialcells[J]. Cancer Research, 2003, 63: 760-765. |
| [4] |
JOSEP MARIA ROIG, MIGUEL MOLINA, ANNA CAS-CANTE, et al. Adenovirus-mediated retinoblastoma 94gene transfer induces human pancreatic tumor regression in amouse xenograft model[J]. Clinical Cancer Research, 2004, 10: 1456-1460. |
| [5] |
STEVENS C W, ZENG M, CERNIGLIAG J, et al. Ionizing ra-diation greatly improves gene transfer efficiency in mammaliancells[J]. Hum Gene Ther, 1996, 7(14): 1727-1734. DOI:10.1089/hum.1996.7.14-1727 |
| [6] |
TANG D C, JENIGLIA R S, SHI Z, et al. Overexpression ofadenovirus-encoded transgenes from the cytomegalovirus im-mediate early promoter in irradiated tumor cells[J]. Hum Gene T-her, 1997, 8(17): 2117-2124. DOI:10.1089/hum.1997.8.17-2117 |
| [7] |
KANAZAWA T, MIZUKAMI H, OKADA T, et al. Suicidegene therapy using AAV-HSVtk/ganciclovir in combinationwith irradiation results in regression of human head and neckcancer xenografts in nude mice[J]. Gene Ther, 2003, 10(1): 51-58. |
| [8] |
BADIE B, KRAMAR MH, LAUR, et al. Adenovirus-me-diated p53 gene delivery potentiates the radiation-inducedgrowth inhibition of experimental brain tumors[J]. J Neurooncol, 1998, 37(3): 217-222. DOI:10.1023/A:1005924925149 |
| [9] |
BIN S.THE, ESTUARDO AGUILAR-CORDOVA, MARLATVLACHAKI, et al. Combining radiotherapy with gene thera-py (from the bench to the bedside) :Anovel treatment strategyfor prostate cancer[J]. The Oncologist, 2002, 7: 458-466. DOI:10.1634/theoncologist.7-5-458 |




