2. 第四军医大学西京医院输血科;
3. 第四军医大学病原生物学教研室;
4. 第四军医大学电镜中心
辐照后的全血回输后可提高患者癌症患者抗辐射能力, 但对于γ射线辐照外周血分离的单个核细胞的抗肿瘤活性, 尤其是中等剂量(1~5Gy)γ射线照射外周血分离的单个核细胞的活性, 国内外尚未见报道。为此, 本研究采用人胃癌细胞系MKN-28细胞和分离的外周血单个核细胞共培养方法, 利用吖啶橙/溴化乙锭(AO/EB)荧光双染色法, 对1~5Gyγ射线辐照分离后的外周血单个核细胞的抗肿瘤活性进行了观察, 以探讨不同剂量γ射线辐照后的外周血单个核细胞与抗肿瘤活性的相关性。
1 材料和方法 1.1 材料人胃癌细胞系MKN-28由第四军医大学实验动物中心馈赠, 胎牛血清(fetal calf serum, FCS)购自北京元亨圣马生物技术研究所, RPM I1640购自GIBCO公司, AO/EB染色液购于美国One Lambda公司, 倒置荧光显微镜为日本OLYMPUS公司BX60型, 血液辐照仪为加拿大Nordian公司Gammacell R 1000Elan型。
1.2 单个核细胞分离从无偿献血者捐献的全血(第四军医大学西京医院输血科提供)中抽取白膜, 放入刻度离心管内, 1 000rpm离心10min, 弃去上层血浆及血小板, 其沉淀的血细胞再用RPMI1640培养液按1:2(V/V)稀释混匀。另取一离心管, 用毛细滴管吸取3~4ml淋巴细胞分离液小心地加入离心管底部, 并沿离心管壁徐徐加入5~6ml稀释的细胞悬液, 然后置于水平转子离心机中, 以2000rpm离心20min。离心完毕, 用直头平口吸管吸取云雾状的淋巴细胞层, 加入5倍体积RPMI1640用1500rpm离心5min洗涤2次。最后加适量含10% FCS的RPMI1640培养基制成细胞数为2×105/ml的细胞悬液, 分装到青霉素瓶中, 每瓶2ml备用。
1.3 肿瘤细胞接种肿瘤细胞按常规复苏后接种于含10%灭活胎牛血清、100U/ml青霉素、100μg/ml链霉素的RPM I1640培养基瓶中, 置于5%的CO2、饱和湿度和37℃条件下培养, 待细胞数占满瓶底80%时, 用0.25%胰蛋白酶溶液消化传代, 取对数生长期细胞用于实验。在实验时用含10%FCS的RPM I1640重新悬浮计数, 制成4×104个细胞/ml悬液, 加入96孔培养板中, 每孔100μl, 二氧化碳培养箱培养24h。
1.4 辐照及细胞培养实验中所用PBMCs分为未照射(对照)和照射两组, 照射组照射剂量分别为0.5、1.0、1.5、2.0、2.5和3.0Gy。然后分别加入上述已接种肿瘤细胞的96孔板中与肿瘤细胞共培养, 同时各照射组和未照射组的单个核细胞均设不加肿瘤细胞的空白对照孔, 每孔加100μl单个核细胞及RPMI100μl1640培养液。
1.5 AO/EB染色在实验过程中每天取单纯肿瘤细胞、未照射和不同剂量照射后的单纯外周血单个核细胞、未照射和不同剂量照射后的外周血单个核细胞和瘤细胞共培养组各3孔, 在每孔中加入30μlAO/EB染色液, 室温染色15min, 倒置荧光显微镜下观察细胞状态, AO和EB用488nm激发后, 分别用525/20nm滤片和635/20nm滤片检测[3]。连续观察10d, 实验共重复3次。
2 结果 2.1 单纯肿瘤细胞对照组培养的单纯肿瘤细胞对照组, 在实验的所有时间点生长良好, 增殖明显, 并可见瘤巨细胞形成。
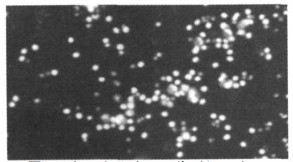
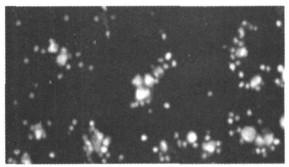
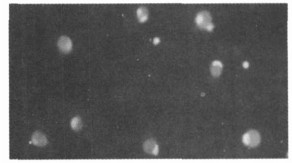
2.2 单纯照射或未照射外周血单个核细胞对照组单纯未照射的外周血单个核细胞, 在144h仍有大量活的单个核细胞, 细胞数未见明显减少, 死亡细胞少见(见图 1)。各照射组与未照射组相比, 在144h时有比较明显的细胞死亡(见图 2)。在培养10d(240h)时, 照射和未照射组单个核细胞都减少, 但未照射组仍有较多活的单个核细胞, 而照射组活的小细胞较少。照射和未照射单个核细胞对照组都出现体积较大的细胞(见图 3), 部分细胞有明显突起。
|
图 1 未照射的外周血单个核细胞, 培养144h(AO/EB×200) |
|
图 2 1Gy照射的外周血单个核细胞, 培养144h(AO/EB×200) |
|
图 3 2.5Gy照射的外周血单个核细胞, 培养240h(AO/EB×200) |
个核细胞与肿瘤细胞共培养组未照射的外周血单个核细胞与肿瘤细胞共培养组, 在单个核细胞加入肿瘤细胞孔内后, 出现大量单个核细胞围绕肿瘤细胞形成花环样结构, 48h后可见大量单个核细胞包围肿瘤细胞形成团块样结构。72h肿瘤细胞和淋巴细胞开始明显死亡, 但仍可见较多活淋巴细胞和少量肿瘤细胞, 96h后可见淋巴细胞大量死亡, 少量肿瘤细胞残存, 120h后, 仅见个别肿瘤细胞残存, 单个核细胞已几乎全部死亡, 240h时, 残存的肿瘤细胞有增生现象。
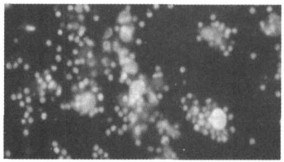
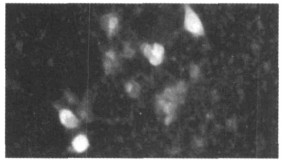
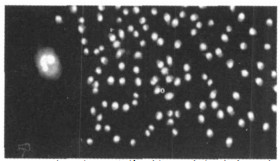
2.4 不同剂量照射的外周血单个核细胞与肿瘤细胞共培养组不同辐照剂量照射的外周血单个核细胞, 与肿瘤细胞作用后, 在不同时间有不同表现。在单个核细胞加入肿瘤细胞后即可发现, 各组单个核细胞就围绕肿瘤细胞形成的花环样结构, 24h后肿瘤细胞周围围绕的单个核细胞逐渐增厚, 尤其以1Gy照射组出现的花环层更厚、更明显(见图 4)。至48h时, 除3Gy组外, 其他各组单个核细胞均包裹肿瘤细胞形成团块样结构, 各组淋巴细胞和肿瘤细胞都明显死亡。至72h时, 各剂量组团块样结构减少, 死亡的淋巴细胞和肿瘤细胞明显增加, 可见大量坏死细胞碎片(见图 5), 1Gy组在72h时虽仍可见较多淋巴细胞, 但肿瘤细胞已少见。混合培养96h后, 0.5~2.0Gy组除偶见存活的淋巴细胞外, 均未见存活肿瘤细胞。2.5Gy组自96h至240h均可见少量存活的肿瘤细胞, 但增生不活跃, 淋巴细胞少见(见图 6)。3Gy组自96h至120h存活的肿瘤细胞仍较多, 未见活淋巴细胞; 在培养144h后, 残存的肿瘤细胞开始增生, 至240h, 残存的肿瘤细胞开始克隆样增生, 形成细胞团, 细胞体积较小, 有瘤巨细胞出现(见图 7)。
|
图 4 1Gyγ射线辐照的单个核细胞与肿瘤细胞共培养24h(AO/EB×200) |

|
图 5 2Gyγ射线辐照的单个核细胞与肿瘤细胞共培养48h(AO/EB×200) |
|
图 6 2.50Gyγ射线辐照的单个核细胞与肿瘤细胞共培养96h(AO/EB×200) |
|
图 7 3Gyγ射线辐照的单个核细胞与肿瘤细胞共培养240h(AO/EB×200) |
放射剂量一般分为低剂量(1Gy以下)、中低剂量(1.0~ 2.0Gy)、中高剂量(2.0~5.0Gy)、高剂量(5.0Gy), 其中剂量在5~7Gy时为非常高剂量, 而大于10Gy则为超高剂量。有文献报道低剂量0.2~0.5Gy辐射自体血可刺激机体的免疫功能[4], 但对发挥作用的细胞未进行详细研究。本实验发现单纯单个核细胞组, 在细胞培养144h后, 不同剂量照射的单个核细胞大部分死亡, 存活细胞明显减少, 而未照射的单个核细胞组细胞未见明显减少, 仍见大量活细胞, 由此说明照射对单个核细胞肯定具有损伤作用, 这种损伤作用似有随照射剂量增加而增强的趋势, 但不明显。在单纯单个核细胞对照组, 培养72h后即可见有体积较大的细胞出现, 240h时, 无论照射还是未照射组, 存活的单个核细胞都已很少, 而出现很多体积较大的细胞, 推测小细胞为淋巴细胞, 随培养时间的延长而自然死亡, 而大细胞性质还不清楚, 可能来自血液中的单核细胞、树突状细胞等, 其性质在进一步鉴定中。
在单个核细胞与肿瘤细胞共培养组, 我们发现单个核细胞具有明显的趋肿瘤细胞性, 在单个核细胞加入肿瘤细胞后, 发现单个核细胞围绕肿瘤细胞形成的花环样结构, 24h后肿瘤细胞周围围绕的单个核细胞层逐渐增厚, 至48h, 除3Gy组外, 各组可见单个核细胞围绕肿瘤细胞形成的团块样结构, 随着共培养时间延长, 肿瘤细胞周围出现越来越多的单个核细胞, 出现这种现象的原因还不清楚, 可能是肿瘤细胞产生的某种物质对单个核细胞有趋化作用所致。经0.5~2.0Gyγ射线照射后的单个核细胞对肿瘤细胞的杀伤作用与未照射组比较明显增强, 其中以1.0Gy照射组对肿瘤细胞的杀伤作用似乎更强一些。而在剂量为2.5~3Gy辐照时对外周血单个核细胞没有提高其杀伤肿瘤细胞能力的作用, 尤其是3.0Gyγ辐照组的杀肿瘤细胞作用似有减弱, 由此可以肯定, 低剂量照射可以提高外周血单个核细胞的杀肿瘤作用, 但对辐射增强外周血单个核细胞杀肿瘤细胞的机理还不清楚, 对该机理的进一步研究, 有利于解释照射对人外周血单个核细胞既有损伤又有免疫增强作用这一看似矛盾的现象。
本研究的结果还发现, 各共培养组中的单个核细胞与其各自单纯单个核细胞对照组比, 单个和细胞存活时间明显缩短, 这表明肿瘤细胞对单个核细胞具有杀伤作用, 但其杀伤机理还不清楚。
Chapman等[6]发现小剂量(1.8~2.0Gy)辐照可对细胞产生灭活作用, 还发现造成培养细胞染色质凝集的辐射剂量为2 Gy[6], 本实验在2.5和3.0Gy组才出现明显的外周血单个核细胞死亡, 与以上发现基本一致。但李志强等[7]通过观察不同剂量60Co辐照后血细胞的超微结构, 认为经15~35Gy超高剂量辐照后血液除部分嗜中性粒细胞与淋巴细胞超微结构有影响外, 对其他血细胞超微结构几乎无影响。徐文皓等[8]的研究发现15Gy辐照后对3种表型的T细胞分泌表达的细胞因子的影响也不大, 只有20~35Gy各剂量组里, 对3种表型的T细胞分泌表达的细胞因子才有不同程度的影响, 且剂量越大, 影响越大, 抑制效应也越明显。但以上实验中均未观察中等剂量(1.0~5.0Gy)辐照对血细胞的影响。因此, 2.5~3.0Gyγ射线辐照后出现杀伤减弱的机理还不能完全用辐射造成的外周血单个核细胞损伤解释, 可能与肿瘤细胞通过表达无功能的Fas或Fas分子表达下调有关[8]。
本研究通过在体外对不同照射剂量的外周血单个核细胞对培养的肝癌细胞系MKN-28的杀伤作用进行的观察结果表明, 经0.5~2.0Gyγ射线辐照后的外周血单个核细胞虽有损伤, 但其杀伤肿瘤细胞的活性明显增强, 但是在剂量增大后, 外周血单个核细胞杀伤肿瘤细胞的效果不明显, 因此, 如果采用自体血辐照回输进行抗肿瘤治疗或者诱导机体的适应性反应时, 最好采用低剂量或中低剂量的γ射线辐照, 但是其作用机制以及在临床上的应用还有待进一步研究。
| [1] |
刘树铮, 刘伟宏, 齐进, 等. 低剂量辐射增强免疫的细胞机制[J]. 中华放射医学与防护杂志, 1992, 12(5): 299-305. |
| [2] |
封丽, 邓大平. 低剂量辐射抗肿瘤治疗的研究进展[J]. 中国辐射卫生, 2006, 15(3): 377-378. DOI:10.3969/j.issn.1004-714X.2006.03.073 |
| [3] |
WANG Y K, HUANG Z Q. Protective effects of icariin on human umbilical vein endothelial cell injury induced by H2O2 in vitro[J]. Pharmacol Res, 2005, 5(2): 174-182. |
| [4] |
范士怀, 贺方学, 葛来增, 等. 自体血照射回输在鼻咽癌放疗治疗中的作用[J]. 中华放射医学与防护杂志, 2002, 22(1): 42-43. DOI:10.3760/cma.j.issn.0254-5098.2002.01.017 |
| [5] |
CHAPMAN J D, STOBBE C C, GALES T, et al. Condensed chromatin and cell inactivation by sing le-hit kinetics[J]. Radiat Res, 1999, 151(4): 433-441. DOI:10.2307/3579830 |
| [6] |
CHAPMAN J D, STOBBE C C, Matsumoto Y. Chromatin compaction and tumor cell radio sensitivity at 2 gray[J]. Am J Clin Oncol, 2001, 24(5): 509-515. DOI:10.1097/00000421-200110000-00019 |
| [7] |
李志强, 徐文皓, 乐嘉宜. 不同剂量60Co辐照血血细胞超微结构的变化[J]. 中国输血杂志, 2004, 17(3): 143-146. DOI:10.3969/j.issn.1004-549X.2004.03.001 |
| [8] |
徐文皓, 胡来光, 李志强, 等. 60Coγ线辐照全血对T淋巴细胞分泌细胞因子的影响[J]. 临床血液学杂志, 2005, 18(5): 296-298. DOI:10.3969/j.issn.1004-2806.2005.05.015 |
| [9] |
NAGAO M, NAKAJIMA Y, HISANAG M, et al. The alteration of Fas receptor and ligand system in hepatocellular carcinom as:how do hepatom a cells escape from the host immune surveillance in vivo[J]. Hepatology, 1999, 30(2): 413-421. DOI:10.1002/(ISSN)1527-3350 |



 ,
,