2. 山东医学科学院血液肿瘤研究室
异基因骨髓移植(ALL0-BMT)是治疗或治愈白血病或MDS等患者的重要手段[1]。随着其予处理和移植方案的改进, 以及辅助药物的应用, 已使约50%患者获得长期治愈存活。但其最大的障碍仍是移植物抗宿主病(GVHD), 并成为移植相关死亡的主要原因[2]。多数实验结果已证明去除供体骨髓中T细胞可以减少GVHD反应, 但随后发现白血病的复发率和移植失败率也明显升高[3, 4]。进一步证明其归因于异基因骨髓中的T细胞的去除, 因为它是移植物抗白血病(GVL)的主要效应细胞[5]。因此, 如何选择既减轻GVHD反应又同时保留GVL作用的方法, 成为国内外学者关注和研究的热点之一。本研究探讨了混合骨髓移植减少GVHD反应的实验, 并取得了初步结果。现具体报道如下。
1 材料与方法 1.1 实验动物BALB/C小鼠(H-2d), 18~20g, 80只, 雄性。C57BL/6鼠(H-2b), 18~20g, 20只, 雌性(中国医学科学院动物中心提供)。辐照受鼠:60Co照射剂量率为10cGY, 总剂量8.0Gy, 于山东省农科院辐射中心进行。
1.2 骨髓移植及分组异基因移植组:将C57BL/6鼠脾细胞与骨髓细胞按5 ×106与1.0 ×107比例经尾静脉注入BALB/C小鼠(H-2d)体内; 供受体鼠脾细胞1:1混合组(以下称混合1:1组):5 ×106供受体1:1混合脾细胞与C57BL/6鼠骨髓细胞1.0 ×107移植给BALB/C小鼠; 供受体鼠脾细胞2:1混合组(以下称混合2:1组):供受体2:1混合脾细胞5 ×106与C57BL/6鼠骨髓细胞1.0×107移植给BALB/C小鼠(H-2d); 供受体鼠脾细胞3:1混合组(以下称混合3:1组):供受体3:1混合脾细胞5 ×106与C57BL/6鼠骨髓细胞1.0 ×107移植给BALB/C小鼠(H-2d)。
1.3 观察与检测指标① 一般GVHD反应:脱毛、体位、大小便。②常规病理学检查。③30d死亡率观察。④外周血象的变化:按常规方法进行, 观察移植后7、14和21d时的外周血象变化。⑤嵌合体的测定:于移植后第7天和第14天进行。小鼠处死前5h, 尾静脉注射秋水仙碱7μg/kg, 5h后拉颈处死小鼠, 无菌条件下取出骨髓过4号针头, 使之成为单个核细胞悬液, 离心1 000rpm 10min, 低渗处理, 吸取上清液, 加入预温37℃的0.075MKCl溶液中。37℃静置20min, 加入1:3醋酸:甲醇固定液1ml, 吹打均匀, 1 000rpm 10min, 弃上清夜, 加固定液10ml, 吹匀, 置15min, 重复固定一次, 末次离心后, 弃上清。留下固定液0.5~1ml, 滴片, 凉干, Giemsa染色, 镜下观察20~30个分裂相。⑥小鼠脾结节测定。移植后12d, 拉颈处死小鼠, 取出整体脾脏, 立即放入Bouin氏液中固定, 半个小时后, 解剖镜下计数脾结节。⑦体内混合淋巴细胞培养。移植后4d, 经腹腔注射125I-UdR[3.7 ×104Bq (2μCi)]8h后拉颈处死小鼠, 取脾脏放入70%乙醇中, 浸泡3d, 每天更换浸泡液, 在闪烁计数仪上计数脾脏放射性元素每分钟烁闪数(cpm/min)和注入125I-UdR标准cpm/min, 并以脾脏重量更正。
2 结果 2.1 GVHD反应混合1:1组与2:1组GVHD反应较轻, 以弓背体位及腹泻为主, 异基因组和混合3:1组的GVHD反应明显。脱毛现象发生率分别为35%(7/20)和30%(6/20), 轻度弓背体位发生率分别为40%(8/20)和35%(7/20), 大便次数增多及便稀现象的发生率分别为30%(6/20)和25%(5/20)。两组间的发生率无明显差别。异基因组、混合1:1组、混合2:1组及混合3:1组的30d死亡率分别为50%(10/20)、15%(3/20)、25%(5/20)和45%(9/20)和55%(11/20)。
2.2 病理学检查根据皮肤、脾脏、肝脏和小肠的病理改变, 异基因组、混合3:1组为GVHDⅡ级反应, 混合1:1组和2:1组为GVHDI级反应。
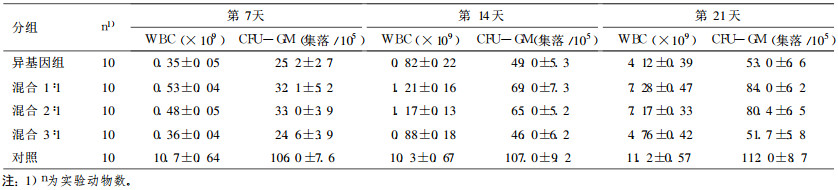
2.3 受体鼠外周血白细胞的变化经过受体鼠外周血白细胞的变化, 以混合1:1组恢复最高, 混合2:1组次之, 异基因组和混合3:1组的恢复水平较上述两组为低。说明异基因与同基因脾细胞1:1和2:1的混合骨髓移植可以减轻GVHD反应, 有利受体鼠造血恢复, 减少死亡率。结果如表 1所示。
|
|
表 1 BMT后GM-CFUc及外周血细胞测定 |
GM-CFU的变化受体鼠接受不同骨髓移植后, 均有较高水平的GM-CFU生成率。其中以混合骨髓移植1:1组和2:1组恢复为较高, 两组间差异无显著性(P> 0.05)。异基因对照组及混合3:1组的白细胞较低。具体结果参见表 1所示。
2.5 GM-CFUc及外周血细胞测定(表 1) 2.6 受体鼠脾脏结节的变化移植后第12天, 观测各实验组脾脏结节数, 异基因组、混合1:1, 2:1, 3:1组的脾结节数分别为(45.6±7.6)/脾膈面、(124.5±15.6)/脾膈面、(116.5 ±31.2)/脾膈面、(56.3 ±15.2)/脾膈面。从受体鼠脾脏结节的计数结果发现, 混合1:1组和2:1组结节数较高, 与异基因组和混合3:1组比较, 并具有明显的统计学意义(P < 0.05)。说明混合1:1和混合2:1组的移植方式可以明显的促进受体鼠造血恢复。
2.7 受体鼠体内混合淋巴细胞培养的测定结果125I-UdR摄入试验表明混合1:1组和2:1组的脾淋巴细胞反应较弱。异基因组和混合3:1组体内混合淋巴细胞反应较强。按脾脏125I-UdR摄取率(%)=(脾脏细胞计数-本底)/(标准计数-本底)×100%计算。移植6d后, 异基因组、混合1:1、2:1和3:1组125I-UdR摄取率分别为(0.61 ±0.10)%, (0.16 ±0.04)%, (0.21 ±0.04)%和(0.57 ±0.05)%。
3 讨论近年来, 急性白血病的异基因骨髓移植(ALLO-BMT)的研究与应用有了很大进展。然而, 因为主要组织相容性抗原复合物(MHC)屏障的存在, 使移植物抗宿主病(GVHD)成为移植相关死亡的主要原因之一。所以, 如何防止或减少GVHD反应是国内外学者关注的热点之一[1]。其中在机理研究方面已获得较肯定结果, 即GVHD反应与供者的T细胞有关。骨髓移植后, 供者的T细胞识别受者主要组织相容性抗原系统, 从而激活细胞毒T细胞, 活化的T细胞释放多种淋巴细胞因子, 引起非特异性组织细胞损害[6]。其中自然杀伤细胞也可以参与GVHD的病理过程。GVHD是全身性疾病, 但以皮肤、肝脏及消化道受累为最常见。
正因为GVHD关系到Allo-BMT的成功与否, 所以, 国内外学者根据GVHD反应的发生机制, 在如何防止GVHD方面进行了较多的探索与实验[3, 4], 并取得了某些进展。如经过单克隆抗体等方法清除移植骨髓中的T细胞的方法[1]。虽然较多的实验结果证实该方法的确可以减少或者消除GVHD反应, 但伴随移植治疗白血病失败或复发率升高的事实又不支持单纯清除T细胞的移植方式[3, 4]。经过进一步的研究与尝试, 证实少量多次骨髓移植[7]及混合骨髓移植[8, 9]等方法可以不同程度的减轻GVHD反应。
本实验在证实活化半相合骨髓移植减轻GVHD反应基础上, 又借鉴其他学者利用混合供受体骨髓细胞移植方法可以减少GVHD反应的结果[9], 进行混合骨髓移植。结果表明作为对照的异基因骨髓移植组发生明显GVHD反应, 混合1:1组和混合2:1组GVHD反应明显减弱。具体表现为混合1:1组和混合2:1组的脾淋巴细胞反应较弱, 外周白细胞数量增高, 骨髓GM-CFU集落形成较多, 30d生存率较高。而异基因脾细胞和同基因脾细胞3:1组则不能明显减轻GVHD反应。说明同基因脾细胞比例较高的活化半相合混合骨髓移植方式才可以降低GVHD反应, 减少GVHD造成的死亡。至于该移植方式降低GVHD反应的具体机制, 部分学者认为其归因于同基因淋巴细胞经抑制异基因淋巴细胞反应而诱导耐受性[8]。因此, 研究结果初步表明供受体活化脾细胞在一定合适比例下, 可以明显的减少移植排斥反应。至于此种移植方式的抗白血病作用, 需要进一步研究。
| [1] |
异基因骨髓移植专题笔谈·异基因骨髓移植治疗血液病[J].中华血液学杂志, 1992, 13(11): 594.
|
| [2] |
罗辉, 胡盛惠, 杨平地. 清除小鼠特异性活化淋巴细胞预防移植物抗宿主病的研究[J]. 中华血液学杂志, 1995, 16(10): 521-523. |
| [3] |
BUTLURINI A, GALE RP. Tcell depletion in bonemarrow transp lantation for leukemia: current results and future directions[J]. BMT, 1988, 3: 185-192. |
| [4] |
PAUL JM, JOHN A, HANSEN C. Effects of in vitro depletion of T cells in HLA-identical allogeneic marrow grafts[J]. Blood, 1985, 66: 664. |
| [5] |
SYKES M, HARTY MW, SZOT GL. Il-2 in hibits graft versus host disease promoting activity of CD4+ cells while preserving CD4 and CD8 mediated graft versus leukemia effects[J]. Blood, 1994, 83: 2560-2569. |
| [6] |
GALE RP. Graft-versus-host disease[J]. Immunol REV, 1985, 88: 193. DOI:10.1111/imr.1985.88.issue-1 |
| [7] |
项莺松, 杨如俊, 孟祥顺, 等. 小鼠骨髓程序移植的实验研究[J]. 中华血液学杂志, 1998, 19: 634-637. DOI:10.3760/j:issn:0253-2727.1998.12.005 |
| [8] |
ILASTSD ST, WREN SM, BLUESTONE JA. Effects of selective T cell depletion of host and/or donor bone marrowon lymphopoietic repopulation, tolerance, and graft-versus-host disease on mixed allogeneic chimeras (B10+B10D2→B10)[J]. Jimmunol, 1996, 136: 28-33l. |
| [9] |
罗辉, 杨平地, 贺福初. 混合骨髓移植的实验研究[J]. 中华血液学杂志, 1998, 19: 418-421. DOI:10.3760/j:issn:0253-2727.1998.08.007 |