人群流行病学调查的结果表明, 输电线工频磁场(属于极低频磁场, ELF-MF)暴露可能与白血病和乳腺癌等发病率增高有关[1], 国际癌症研究机构(IARC, 2001)和美国环境健康科学研究所(NIEHS, 1998)均把ELF-MF定义为人类的可疑致癌源。环境电磁辐射与肿瘤及癌症发生的关系及机制是目前环境健康研究工作中最主要的挑战之一。肿瘤及癌细胞的显著特征包括细胞增殖失控及细胞迁移性改变, 而细胞的这些生命活动都与细胞骨架密切相关。我们研究工频磁场刺激对细胞骨架的影响旨在探索ELF-MF与肿瘤、癌症发生的关系及机制。
F - actin是细胞骨架的一种, 在细胞质中成束状平行排列(应力纤维)或疏散成网状。它是由肌动蛋白单体(G - actin)组装成的多聚体, 在细胞的功能中起着至关重要的作用。有关磁场刺激对细胞F - actin骨架的影响方面只有零星报道。从信号转导途径看, 肌动蛋白(actin)位于表皮生长因子受体(EGFR)的下游信号通路上[2]。有报道称, 在配体缺或的情况下, 0. 4mT工频磁场可诱导CHL细胞膜上EGFR发生聚集[3]。我们前期的实验中也发现0. 4mT工频磁场能引起离体和在体的EGFR发生聚簇[4, 5]。受体聚簇是细胞信息传递过程的前提[6], 0. 4m T工频磁场作为一种外界刺激既然可以导致细胞的EGFR发生聚集, 就可能通过EGRF的信号通路影响到与EGFR密切联系的F - actin骨架信号通路, 并进一步影响细胞生理行为。在本文中我们用0. 4mT工频磁场辐照CHL细胞, 初步探讨了0. 4mT工频磁场是否可通过激活EGFR信号通路引起F - actin发生变化, 从而影响细胞行为。
1 实验材料与方法 1.1 主要试剂phalloidin - TRITC、表皮生长因子(EGF), Hepes、Triton X - 100(美国S igm a公司), EGFR一抗(美国Santa Cruz公司), HRP标记二抗及Western - blotting实验用品购于北京鼎国生物技术有限公司, CHL细胞购于中科院细胞所。细胞培养基购于上海实生细胞生物技术有限公司。其它试剂为国产分析纯。
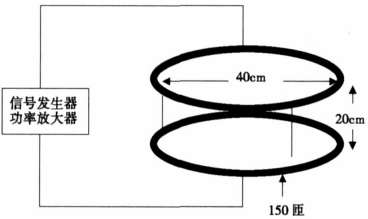
1.2 磁场辐照系统磁场辐照系统由一对半径为20 cm、高20 cm、150匝的Helmholtz线圈、信号发生装置和功率放大器组成。其中线圈部分置于隔水式电热恒温细胞培养箱(PXY - DHS - Ⅱ型, 上海跃进医疗器械)中, 线圈的两个端线与培养箱外的调压器相连。经CT3 - A型交直流高斯计(上海第四电表厂)测定, 在Helmholtz线圈中央区域(半径为5 cm、高为10 cm)内形成一个恒温、均匀、强度在0 ~ 0. 5 mT之间连续可调的50 H z正弦磁场辐照区。
|
图 1 磁场辐照实验装置 |
CHL细胞在RPMI-1640培养基中(10%的小牛血清、100U/mL青霉素和100U/mL链霉素)、5% CO2及37℃条件下常规培养。消化液为0.25%胰酶。
1.4 F - actin形态的观察取5 ~ 7代的细胞, 以2 ×105 / ml的密度接种到铺有盖玻片的6孔板中, 每孔2mL细胞悬液, 培养2d左右, 实验前换成无血清培养基。细胞经磁场辐照或50nmol/L的EGF处理30min(均在37℃下进行, 每组实验至少重复3次, 每次3~ 5个平行样品), 同时设对照组。细胞处理完成后依次进行如下操作:4%多聚甲醛固定15 min, 0. 2% TritonX-100透化15 min, phalloidin - TRITC(0.5μg /ml)标记1h, 以上操作均在室温下进行。每步之间需用PBS清洗3遍, 每遍5min。最后用95%的甘油封片, 激光共聚焦荧光显微镜(Olympus FV1000)观察拍照。
1.5 W estern - b lotting分析细胞骨架样品中的EGFR含量参照文献[7]中的方法制备细胞骨架样品:细胞接种到培养皿中, 经磁场辐照或50nmol /LEGF处理30min, 同时设对照组, 之后立即用细胞刮将其收集到含5mmol/L乙二胺四乙酸(EDTA)的冰冷PBS中, 血细胞计数后取107个细胞离心收集, 加入500μl裂解液(25 mmol/LHepes, pH 7. 4, 2 mmol/LMnCl2, 1 mmol/LAEBSF, 10 mmol/LNa3VO4, 4 mmol/L碘乙酸, 0. 15% Triton X-100)), 4℃裂解10min后, 9 000g冷冻离心5min, 得到的沉淀部分就是细胞骨架样品, 加入电泳上样缓冲液200μl, 取30μl煮沸5min上样。经SDS聚丙烯酰胺凝胶电泳(Horfermini VE电泳仪, 5%浓缩胶, 6% ~ 10%分离胶)分离后, 取下平板凝胶, 将蛋白转到硝酸纤维素膜上(DYY - 7C型电转仪, 北京六一厂, 200mA恒流转2h)。按Santa Cruz说明作蛋白印记杂交, ECL发光法检测目的蛋白, 经凝胶成像仪(VILBER LOURMAT)成像。
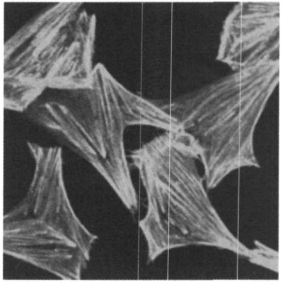
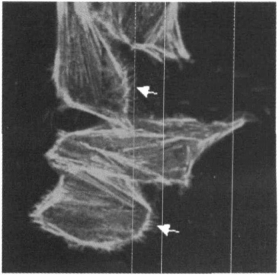
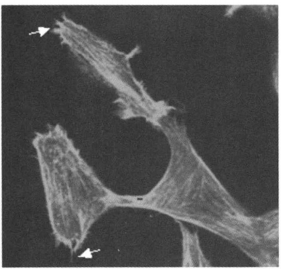
2 实验结果 2.1 0.4mT工频磁场及EGF对CHL细胞F - actin的影响用phallicidin - TRITC标记F -actin。phallicidin是一种双环杆肽, 与F-actin有强亲合作用, 且只与F-actin结合, 而不与G - actin结合, 荧光标记的phallicidin可清晰地显示细胞中的F - actin。CHL细胞未经任何处理放置30min, phallicidin - TRITC标记F - actin后在激光共聚焦荧光显微镜下观察, 可见清晰的平行排列的应力纤维(图 2)。0. 4mT工频磁场辐照CH L细胞30min后, 应力纤维明显减少, 部分细胞周边出现丝状伪足(图 3, 箭头)。细胞经50nmol /L的EGF作用30min后也有应力纤维减少现象, 并有丝状伪足出现(图 4, 箭头)。以往有研究结果表明配体EGF诱导EGFR发生二聚化后能引起细胞F - actin应力纤维减少[8], 与我们的实验结果一致。从图 3和图 4可见:磁场辐照与EGF处理对CHL细胞F - actin的形态产生的影响极为类似, 即0. 4mT工频磁场辐照CHL细胞产生了与EGF类似的后续效应。
|
图 2 正常CHL细胞中F - actin的形态 |
|
图 3 0.4mT工频磁场辐照CHL细胞30min后F-actin的形态 |
|
图 4 CHL细胞经50nmol/L的EGF作用30min后F-actin的形态 |
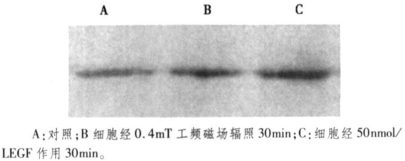
细胞经裂解液中的去垢剂Triton X - 100作用后, 离心收集到的样品是去垢剂不可溶的细胞骨架及与之相连的蛋白。以往的研究结果表明配体EGF诱导EGFR发生二聚化, EGFR由低亲和性群组变为高亲和性群组, 而高亲和性群组的EGFR与去垢剂不可溶的骨架蛋白actin相连, 这使得与去垢剂不可溶的骨架蛋白相连的EGFR增多[9], 即配体诱导EGFR发生聚簇后, 可以通过信号转导引起去垢剂不可溶的骨架样品中EGFR含量增加。我们用Western - blotting检测磁场及EGF作用后去垢剂TritonX - 100不可溶的骨架样品中EGFR的含量, 结果显示:0.4mT工频磁场辐照CHL细胞30min使细胞骨架样品中的EGFR明显增多(图 5B), 而50nmol/L的EGF处理CHL细胞30min后也使骨架样品中的EGFR明显增多(图 3C), 磁场辐照的效果与EGF类似。
|
图 5 去垢剂不可溶的细胞骨架样品中EGFR的免疫印迹图 |
F - actin骨架的结构与细胞的病理过程, 如细胞的趋化、粘附、粘弹等过程密切相关。与此同时, 细胞形态的维持、细胞分裂、胞内物资的运输和细胞分化等活动都与F - actin骨架相关, 所以, F - actin骨架在细胞的功能中起着至关重要的作用, 是低频电磁场刺激导致细胞生理、病理变化的潜在的作用点[10]。微丝骨架的改变必然影响细胞功能, 0. 4mT工频磁场辐照引起CHL细胞F - actin的显著变化提示0. 4mT工频磁场辐照会影响CHL细胞的细胞功能。
已有大量实验证明弱磁场的确会引起显著的生物效应如改变细胞增殖、抑制细胞凋亡、以及改变基因转录等。但因为ELF -MF能量低, 不像电离辐射能引起生物大分子的损伤, 也不像射频和微波那样可通过致热而引起生物学效应, 因此, 环境中的极低频电磁场(ELF-MF)是否以及如何引发生物学效应一直是生物电磁学领域争论的热点。以往的研究结果表明, 外加低强度ELF-MF作为信号分子作用于细胞膜, 可通过细胞信号转导途径传递和放大信息, 最终导致细胞行为和性质的变化[11]。从信号转导通路看, F-actin骨架肌动蛋白位于表皮生长因子受体(EGFR)的下游信号通路上, 在EGFR的酪氨酸激酶(TK)域附近的残基AA 984 - 996之间有细胞骨架肌动蛋白的结合位点, EGFR的信号通路发生变化就可能影响到F- actin骨架信号通路。我们用phallicidin-TRITC标记微丝并用Western - blotting检测去垢剂不可溶的骨架样品中EGFR的含量, 结果0. 4mT工频磁场辐照CHL细胞后, F-actin形态的变化规律及EGFR在去垢剂不可溶的骨架样品中的变化规律与配体EGF引起的变化极为相似, 而0. 4mT工频磁场已被证明能够引起CHL细胞膜上EGFR发生与配体EGF诱导类似的聚集[4], 这提示0. 4mT工频磁场对CHL细胞F-actin骨架的影响与磁场诱导EGFR聚集, 并引起信号向下传递有关。
工频磁场对成纤维细胞F-actin骨架形态产生影响提示我们, 人类居住环境中的电磁场可能会通过信号转导影响到F-actin的装配, 改变细胞与F-actin骨架密切相关的迁移、增殖等一系列行为, 甚至导致细胞性质的改变, 最终影响生物体的健康。
致谢: 感谢上海奥林巴斯公司实验上的支持
| [1] |
KLIUKIENE J, TYNES T, ANDERSEN A. Residential and occupationa lexposures to 50-Hzmagnetic fields and breast cancer in women:a population - based study[J]. Am JEpidemiol, 2004, 159: 852-861. DOI:10.1093/aje/kwh116 |
| [2] |
DEN HARTIGH JC, VAN BERGEN EN, HENEGOUWEN PM, et al. The EGF receptor is an actin - binding protein[J]. J. Cell Biol, 1992, 119: 349-355. DOI:10.1083/jcb.119.2.349 |
| [3] |
孙文均, 付一提, 鲁德强, 等. 工频磁场诱导肺成纤维细胞膜受体聚簇及噪声磁场的干预作用[J]. 中华预防医学杂志, 2004, 38(1): 5-7. DOI:10.3760/j:issn:0253-9624.2004.01.002 |
| [4] |
贾彩丽, 周贞洁, 刘仁臣, 等. 50 H z弱磁场诱导离体表皮生长因子受体聚集[J]. 生物物理学报, 2005, 21(4): 269-276. DOI:10.3321/j.issn:1000-6737.2005.04.003 |
| [5] |
JIA CAIL I, ZHOU ZHEN JIE, LIU REN CHEN, et al. EGF receptor clustering is induced by a 0.4mT power frequency magnetic field and blocked by the EGF receptorty rosine kinase inhibitor PD153035. Bioelectrom agnetics, has been recept[Z].
|
| [6] |
YU XIAOCHUN, KAILASHD SHARM A, TSUYOSHI TAKAHASHI, et al. Ligand - independentdimer form ation of epidermal growth factor receptor (EGFR) is a step separable from ligand - induced EGFR signaling[J]. Molecular Biology of the Cell, 2002, 13: 2547. DOI:10.1091/mbc.01-08-0411 |
| [7] |
JAMESM NELSON, DAVIDW FRY. Cytoskeletal and morphological change s associated with the specific supp ression of the epidermal grow thfactor recep tortyrosine kinase activity in A 431 hum an epider moid carcinoma[J]. Experim ental cell research, 1997, 233: 383-390. DOI:10.1006/excr.1997.3571 |
| [8] |
DIAKONOVA M, PAYRASTRE B, VANVELZEN A G, et al. Epidermal grow thfactor induces rapid and transient association of phospholipase C-g1 with EGF - receptor and filamentous actin atmembrane ruffles of A431 cells[J]. J. Cell Sci, 1995, 108: 2499-2509. |
| [9] |
KWIATKOWSKA K, KHREBTUKOVA I A, GUDKOVA DA, et al. Actin-binding proteins involved in the capping of epidermal growth factor receptors in A 431 cells[J]. Cell Sci, 1991, 196(2): 255-263. |
| [10] |
JOACHIM GARTZKE, KLAUS LANGE. Cellular target of weak magnetic fields:ionic conduction along actin filaments of microvilli[J]. Am J Physiol Cell Physiol, 2002, 283: 1333-1346. DOI:10.1152/ajpcell.00167.2002 |
| [11] |
NIE K, HENDERSON A. MAPk inase activation in cells exposed to a 60 Hzelectrom agnetic field[J]. J Cell Biochem, 2003, 90: 1197-1206. DOI:10.1002/(ISSN)1097-4644 |



