随着恶性肿瘤病人的放射治愈率不断提高及患者生存期的延长, 放射线诱发恶性肿瘤(radiation-induced carcinogenesis, RIC)的报道不断增多[1]。鼻咽癌以放射治疗为主要治疗手段, 而且治疗后患者生存期长, 其治疗诱发癌的报道更不鲜见。为探讨放射线诱发恶性肿瘤的有关因素, 笔者对近年国内文献公开发表的鼻咽癌放疗后诱发的恶性肿瘤85例患者进行回顾性分析, 现报道如下。
1 资料及方法 1.1 一般资料鼻咽癌放射治疗诱发恶性肿瘤85例, 男性64例, 女性21例, 男女性别比为3: 1。放疗时年龄18 ~ 70岁, 中位年龄44岁。诱发肿瘤的年龄25 ~ 77岁, 中位年龄47岁。潜伏期2 ~ 26a, 中位潜伏期10a。
1.2 方法对85例鼻咽癌放疗后诱发的恶性肿瘤进行回顾性分析。所有病例放疗前病理均确诊为鼻咽癌, 其中低分化鳞癌78例, 其他病理类型7例。放射治疗以耳前野、面颈联合野及颈部切线野为主野, 全部采用常规分割二维照射。放射源为60Co、深部X射线及6MVX射线。诱发肿瘤区剂量5 800 ~ 9 900cGy, 中位剂量7 000cGy。
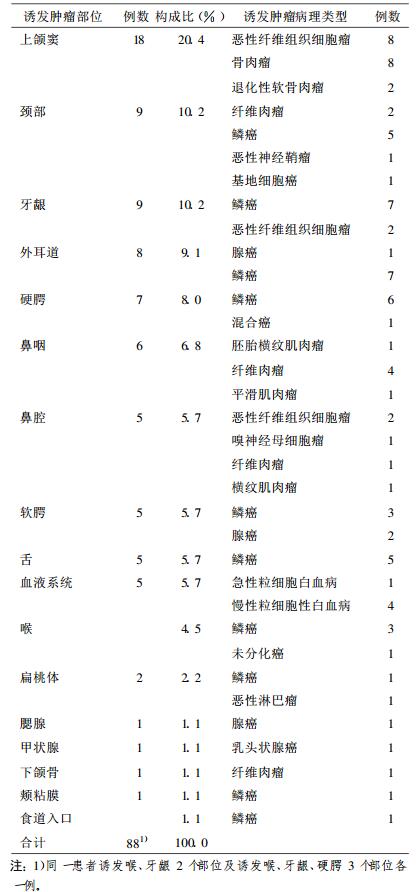
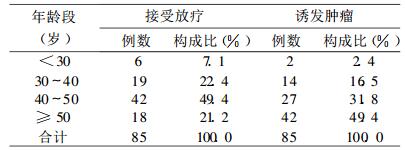
2 结果位于照射野内的共计17个部位见诱发恶性肿瘤, 其中上颌窦为最常见诱发肿瘤部位, 共18例, 占全部诱发肿瘤20.4%。腮腺、甲状腺、颊粘膜、下颌骨及食道入口为较少发部位, 各1例, 见表 1。85例鼻咽癌患者诱发88处恶性肿瘤:癌47例, 占53.4%, 肉瘤41例, 占46.6%;高分化鳞癌39例, 占诱发癌83.0%, 占所有诱发恶性肿瘤44.3%;恶性纤维组织细胞瘤12例, 占诱发肉瘤29.3%, 占所有诱发恶性肿瘤的13.6%。85例患者放疗时年龄以40 ~ 50岁多, 占49.4%, 诱发恶性肿瘤年龄以≥ 50岁多, 占49.4%。见表 2。85例患者单用60Co照射65例, 占76.5%; 60Co+深部X射线照射12例, 占14.1%;单用6MVX射线照射8例, 占9.4%。诱发肿瘤区照射剂量 < 7 000cGy 22例, 占25.9%; 7 000cGy 22例, 占25.9%;> 7 000cGy 41例, 占48.2%。85例患者中38例有再次治疗和随访资料, 再次治疗后中位生存期42个月。最长有截止随访期24a仍存活, 其中17例再次治疗后1年内死亡患者中14例为肉瘤。
|
|
表 1 85例鼻咽癌放疗后诱发恶性肿瘤部位分布情况 |
|
|
表 2 85例鼻咽癌放疗后诱发恶性肿瘤患者年龄构成 |
结合文献[2, 3, 11]诊断标准为:①患者有放射线照射史; ②诱发肿瘤发生在原发肿瘤部位的照射野内; ③如果为肉瘤则照射前组织病理学和/或临床影像学均无已存在肉瘤的证据; ④有相对较长潜伏期, 具体评定标准不定, 大多数认为在2 ~ 56a, 但亦接受 < 2a的短潜伏期; ⑤必须有组织病理学诊断, 诱发肿瘤与原发肿瘤具有不同的组织学类型, 或有依据可排除转移或复发的可能。本研究85例病例完全符合上述标准。放射诱发肿瘤发生的生物学基础与恶性肿瘤自然发生相似, 包括遗传缺陷造成的易感性背景、等位杂合基因的丧失、染色体的畸变或DNA突变等恶性转化。电离辐射可以直接作用于靶细胞诱发恶性转化, 也可能打乱了靶细胞与宿主组织的共存关系, 加速了可能自然出现的癌变的出现时间[2、4 ~ 7]。
3.2 鼻咽癌放疗诱发恶性肿瘤的临床分析85例诱发恶性肿瘤发生于17个部位, 似存在这样的趋势:靠近放射野中心的位置易发生, 如上颌窦后1/3、磨牙区牙龈、鼻咽、鼻腔后份、颈部等, 可能与射野中心位置受照剂量高于周边有关; 受照射体积越多的部位易发生, 如全颈部、大部分上颌骨、几乎全部外耳道等。与文献报道的RIC发生率与照射剂量及受照体积具有相关性相符[7]。放射线诱发恶性肿瘤的潜伏期为3 ~ 56a [3], 本研究为2 ~ 26a。潜伏期有逐渐变短趋势, 可能与由于细胞毒性药物的使用进一步损害了全身和局部的免疫功能, 降低免疫监视和激活潜在病毒, 增加诱发癌的危险性。放射线诱发恶性肿瘤的剂量很难确定, 在全身各部位剂量已不尽相同。多数学者认为3 000 ~ 6 000cGy诱发恶性肿瘤的发生率较高[8]。本研究受照剂量高于7000cGy的仅48.1%(41/85), 似提示高剂量照射更易诱发, 但在7 000cGy及以下的剂量水平未显示出差异(22/85, 22/85)。本组全部采用常规分割, 故分割方式与诱发癌的关系无从探讨。从射线种类来看, 采用60Co照射和/或深部X线照射占90.6%, 可能与相对低能射线在组织内能量分布不均匀, 受照部位浅部剂量高, 骨骼吸收多等有关。文献报道的照射时年龄越小, 诱发癌几率越高, 特别是白血病、恶性淋巴瘤、甲状腺癌等。本组首次放疗年龄在40岁以下仅占29.4%, 40岁及以上占70.6%, 似与年龄正相关, 需结合发病年龄构成比来进一步分析。
3.3 诱发肿瘤的对策某些饮食习惯[1], 可能一定程度阻止或延缓放射诱发癌的发生, 但具体的食物成分搭配及效果评价尚在探索中。抗氧化维生素和矿物质的低摄入会增加肿瘤发生的危险性, Bairati [9]等在一项研究中让随机分组的两组头颈部恶性肿瘤患者分别服用抗氧化维生素(维生素E)和安慰剂, 想通过补足抗氧化维生素降低放射治疗后继发肿瘤的发生率, 结果得出了相反的结论。放射线诱发恶性肿瘤恶性度高, 浸润性强, 疗效较差。治疗依患者具体情况作适当处理, 原则上首选非放射疗法, 对不适宜手术患者或术后复发的患者可考虑放疗。本研究中有资料记载进行了手术和/或二程放疗的38例患者, 中位生存时间为42个月。遗憾的是诱发肉瘤患者有14例在1年内死亡, 究其原因是肉瘤病理恶性程度高, 局部侵袭严重和/或伴有远处转移, 虽然治疗首选外科手术, 但常常由于放疗后纤维化或者其发生部位的限制而难以满意实施; 化疗因原放疗后纤维化疗效欠佳; 再程放疗又受到正常组织耐受域值的限制。
Steevs [10]报道头颈部放疗诱发癌发生率约为0.4%, 是小概率事件。而约70%恶性肿瘤需行放疗, 在头颈部肿瘤中这个比例可能更高, 说明其在肿瘤综合治疗治疗中作用不可替代, 所以放疗诱发恶性肿瘤不应成为临床治疗抉择的限制因素。而且对于诱发的恶性肿瘤, 尤其是诱发癌, 经过积极的综合治疗, 仍然可以取得较好的临床疗效, 但是多样化的干预措施和综合治疗模式还需要临床不断探索。对于放射治疗后长期生存的病人需密切随访, 意识到可能出现放射诱发恶性肿瘤, 早期诊断与治疗[11]。
| [1] |
Lois B.Travis, Charles S.Rabkin, Linda Morris Brown, et al. Cancer Survivorship-Genetic Susceptibility and Second Primary Cancers:Research Strategies and recommendations[J]. Journal of the National Cancer Institute, 2006, 98: 15-25. DOI:10.1093/jnci/djj001 |
| [2] |
刘新帆.电离辐射的诱发恶性肿瘤效应[A].殷尉伯, 谷铣之, 主编.肿瘤放射治疗学[M].北京: 中国协和医科大学出版社, 2002, 35.
|
| [3] |
马缠过, 杨克强. 放射治疗诱发恶性肿瘤32例分析[J]. 中华放射肿瘤学杂志, 2000, 9(2): 108-109. DOI:10.3760/j.issn:1004-4221.2000.02.010 |
| [4] |
Kleinerman RA, Tucker MA, Tarone RE, et al. Risk of new cancers following radio the rapyin long-term survivors of retinoblastoma:an extended follow-up[J]. J Clin Oncol, 2005, 23: 2272-2279. DOI:10.1200/JCO.2005.05.054 |
| [5] |
Sigurdson AJ, Jones IM. Second cancers after radio the rapy:any evidence for radiation-induced genomicin stability[J]. Oncogene, 2003, 22: 7018-7027. DOI:10.1038/sj.onc.1206989 |
| [6] |
Sreekumar A, Kyati MK, Varambally S, et al. Profiling of cancer cells using protein microarrays:discovery of novelra-diation-regulated proteins[J]. Cancer Res, 2001, 61: 7585-7593. |
| [7] |
J.L.Red path.Radiation-induced neoplastic transformation in vitro: Evidence for aprotective effect at low doses of low LET radiation[J].Cancer and Metastasis Reviews, 2004, 23: 333-339.
|
| [8] |
张家钰. 放射治疗诱发恶性肿瘤[J]. 中华放射医学与防护杂志, 1998, 18: 138-139. DOI:10.3760/cma.j.issn.0254-5098.1998.02.032 |
| [9] |
Bairati I, Meyer F, Gelinas M, et al. A randomized trial of antioxidant vitamins to prevent second primary cancers in head and neck cancer patients[J]. Journal of the National Cancer Institute, 2005, 97: 481-488. DOI:10.1093/jnci/dji095 |
| [10] |
Steevs RA, Bataini JP. Neoplasms induced by meagavol tage radiation in the head and neck region[J]. Cancer, 1981, 47: 1770. DOI:10.1002/(ISSN)1097-0142 |
| [11] |
Kevin S, Marian Haber, Robert T, et al.Malignant fibrous histiocytoma of the head and neck after radiation for squa-mous cell carcinoma[Z].
|