2. 济南军区第一疗养院药剂科
肿瘤放射治疗会导致白细胞减少, 淋巴细胞活性和功能下降等副作用, 因此降低辐射对淋巴细胞的损伤是提高放疗疗效的手段之一, 近年来研究发现抗氧化剂可拮抗辐射损伤[1, 2]。β -胡萝卜素是人体必需的脂溶性营养素, 其具有多种生物学功能的重要原因之一是其抗氧化特性[3], 但有关β -胡萝卜素抗辐射损伤的报道较少。天然植物中的β -胡萝卜素以反式结构为主[4], 课题组从杜氏盐藻中提取分离出以顺式结构为主的β -胡萝卜素, 并制备成水溶性的纳米β -胡萝卜素, 对其抗辐射损伤作用进行了系统研究。笔者以对辐射较敏感的淋巴细胞为研究对象, 探讨盐藻β -胡萝卜素体外抗辐射损伤的作用, 为抗辐射损伤物质的应用奠定基础。
1 材料与方法 1.1 材料盐藻β -胡萝卜素, 课题组自西北高原盐湖中生长的杜氏盐藻中提取分离, 制成纳米级水溶性溶液。雄性昆明系小鼠, 体质量(18 ±2)g, 在12h: 12h自然光照条件下饲养, 自由摄食、饮水, 保持室温20 ~ 25℃, 3d后用于实验。RPMI 1640培养基(美国GIBCO公司), 新生小牛血清(杭州四季青公司), PI, RNAase (大连宝生物公司)。考马斯亮蓝, 刀豆球蛋白A(ConA) (美国SIGMA公司)。FCC-7000型同中心回旋式60Co治疗机(新华医疗器械厂), Tecan多功能酶标仪(Tecan公司), Vantage流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 细胞制备脱臼处死小鼠, 无菌条件下取出胸腺, 立即置于盛有RPMI 1640培养液的平皿中, 研磨后过250目滤网制成单细胞悬液。D-Hank′s液洗涤3次, 重悬于含10% NBS的RPMI 1640培养液中, 显微镜下计数, 调整细胞浓度为5×106/ml。
1.2.2 实验分组及照射实验分为5组:阴性对照组, 盐藻β -胡萝卜素组(2mmol /ml、4mmol /ml、8mmol /ml), 模型组。胡萝卜素组加用培养液配制的不同浓度的盐藻β -胡萝卜素, 对照组加相同体积的培养液, 于37℃、5%CO2培养箱中培养2h后, 除阴性对照组外, 其余各组均以60Co射线一次性照射, 距离0.75m, 照射剂量率为0.65Gy /min, 剂量4Gy, 照射4小时后终止培养, 收集细胞, 每份标本做3个平行样进行各项指标检测。
1.2.3 细胞增殖活性96孔培养板中加入细胞悬液100μ l /孔, 每孔加入ConA(10μg /ml)50μl, 测定细胞增殖活性。于终止培养前4h, 每孔加入10mg /ml的MTT5μl, 继续培养4h后每孔加100μl的二甲基亚枫, 在酶标仪上测定490nm处的OD值。
1.2.4 细胞蛋白质含量24孔培养板中加入细胞悬液2ml /孔, 终止培养时离心收集各孔细胞, 重悬在D-Hank′s液中, 计数细胞数, 留取约106个细胞, 以1000rpm离心5min, 弃上清, 加入0.5ml 0.1%的SDS, 放置在100℃, 30min。考马斯亮蓝法, 595nm波长处测定吸光度。以牛血清白蛋白为标准品绘制标准曲线, 计算细胞蛋白质含量。
1.2.5 细胞转化率取终止培养的淋巴细胞, 常规方法制片、固定、染色、镜检。每张计数200个细胞, 计算淋巴细胞转化率。
1.2.6 细胞凋亡检测6孔培养板中加入细胞悬液3ml /孔检测细胞凋亡变化。取终止培养的细胞5 ×106个, 用0.01mol /L D-Hank′s液洗涤3次后, 将细胞迅速加入5ml70%冷乙醇(-20℃)中固定过夜。D-Hank′s液洗涤细胞3次, 悬浮细胞。加100μl RNase, 37℃, 30min, D-Hank′s液洗涤3次, 加PI4℃避光反应30min, 流式细胞仪检测。
1.3 统计方法结果以x±s表示, 采用SPSS 10.0统计软件单因素方差分析和q检验比较各组之间差异的显著性。
2 结果 2.1 淋巴细胞增殖活性和蛋白含量模型组与阴性对照组比较, OD值(细胞的增殖活性)明显降低, β -胡萝卜素中、高剂量组与模型组比较, 细胞增殖活性增高, 差异有统计学意义(P < 0.05, P < 0.01), 蛋白含量增高无统计学意义(P>0.05)。低剂量组与模型组比较, 细胞增殖活性和蛋白含量差异均无统计学意义(P>0.05), 结果见表 1。
|
|
表 1 淋巴细胞增殖活性和蛋白含量(n=3, x±s) |
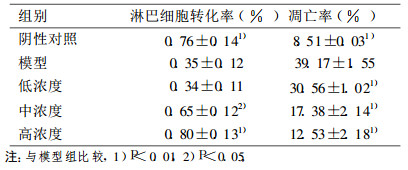
模型组与阴性对照组比较, 淋巴细胞的转化率降低, β -胡萝卜素中、高剂量组与模型组比较, 细胞的转化率增加, 差异有统计学意义(P < 0.05, P < 0.01)。低剂量组与模型组比较, 差异无统计学意义(P>0.05)。而β -胡萝卜素三个剂量组的细胞凋亡率与模型组比较明显降低, 差异有非常显著性(P < 0.01), 结果见表 2。
|
|
表 2 淋巴细胞转化率和凋亡率(n=3, x±s) |
60Co辐射损伤可引发细胞基因突变、细胞坏死、凋亡及酶学与功能改变等病理变化[5]。本实验结果显示, 淋巴细胞经照射后, 各组的细胞增殖活性、淋巴细胞转化率降低, 细胞凋亡增加, 说明60Co辐射损伤了淋巴细胞。β -胡萝卜素各组细胞增殖活性、淋巴细胞转化率都有不同程度的升高, 细胞凋亡率降低。其中高剂量组上述指标与模型组、阴性对照组比较均有统计学意义, 表明高剂量的胡萝卜素不仅对辐射损伤的淋巴细胞有防护作用, 而且对淋巴细胞的增殖和转化还具有一定的刺激作用。各组蛋白含量的差异无统计学意义, 可能是我们的实验时间较短, 细胞虽然受到一定的损伤, 但蛋白合成可能还没有受到太大影响。
关于β -胡萝卜素抗氧化作用已有较多报道, 其中β -胡萝卜素都作为一种脂溶性营养素应用[6, 7]。盐藻β -胡萝卜素由脂溶性经过纳米技术处理成为水溶性营养素, 增加了细胞和机体的吸收, 能更好的发挥其生物学作用, 国内外未见水溶性β -胡萝卜素的相关报道。笔者认为, 在体外培养条件下盐藻β -胡萝卜素能抑制60Co辐射损伤的小鼠胸腺淋巴细胞增殖活性、凋亡等, 对淋巴细胞辐射损伤有良好的防护作用。其作用机制可能在于具有的抗氧化活性, 是一种良好的抗氧化剂, 对辐射产生的自由基引发的链式反应有抑制作用, 从而起到对小鼠胸腺淋巴细胞的保护作用, 其抗辐射损伤的确切机制有待于我们进一步的探索。
| [1] |
杨峥嵘, 吴玉章. 电离辐射对淋巴细胞影响的研究进展[J]. 免疫学杂志, 2002, 18(3): 139-141. DOI:10.3969/j.issn.1008-9810.2002.03.007 |
| [2] |
张萱, 龚守良, 王珍琦, 等. 褪黑素对电离辐射诱导离体小鼠淋巴细胞凋亡的影响[J]. 吉林大学学报(医学版), 2004, 30(5): 668-671. |
| [3] |
陈瑗, 张宝, 周玫. 自由基医学基础与病理生理[M]. 北京: 人民卫生出版社, 2002: 134-163.
|
| [4] |
赵文恩, 韩雅珊, 戴蕴青. 类胡萝卜素的生物学性质[J]. 生物学杂志, 1998, 15(3): 1-31. |
| [5] |
郭毅, 曹新山, 李宗山, 等. 黄芪抗C射线辐射对小鼠淋巴细增殖和IL-2的作用研究[J]. 时珍国医国药, 2004, 15(9): 554-555. DOI:10.3969/j.issn.1008-0805.2004.09.005 |
| [6] |
薛敏波, 洪昭毅. β-胡萝卜素的应用进展[J]. 国外医学妇幼保健分册, 1996, 7(3): 131-133. |
| [7] |
周丽, 梁新乐, 励建荣. 类胡萝卜素抗氧化作用研究进展[J]. 食品研究与开发, 2003, 24(2): 21-23. DOI:10.3969/j.issn.1005-6521.2003.02.008 |