人巨细胞病毒(humancytomealovirus, HCMV)是一种可导致多种疾病的DNA病毒, 在人群中的感染极为普遍, 正常情况下, 病毒处于潜伏感染, 通常为隐形感染, 一旦机体的免疫功能下降, 巨细胞病毒又会被活化从而引起疾病, 如传染性单核细胞增多症、胎儿先天性疾病和间质性肺炎[1]。近几年研究发现HCMV感染与糖尿病[2]、肿瘤[3]、人类动脉粥样硬化甚至是冠心病[4~6]的发生有一定关系, 因此HCMV感染的早期快速诊断有重要的意义。2002年8月~ 2003年3月我们对检测HCMV抗体的常规酶联免疫吸附试验(ELISA)进行了改良, 从缩短反应时间着手, 建立了快速检测人血清HCMV-IgG和HCMVIgM抗体的ELISA方法, 对514例放射工作人员血清进行检测, 以了解济南市放射工作人员HCMV感染状况, 报告如下。
1 材料和方法 1.1 血清标本514名济南地区放射工作人员健康查体血标本, 由山东省医学科学院放射所提供, 抽取静脉血2ml, 分离出血清, 置-20℃冰箱保存; 类风湿因子阳性血清来自济南市各大医院; HCMV-IgM和HCMV-IgG强阳性、弱阳性、阴性混合血清标本来自济南市计划生育门诊。
1.2 试剂辣根过氧化物酶(HRP)标记的羊抗人IgG(γ链)和IgM(μ链)购于SIGMA公司; 聚乙二醇(PEG)粉剂分子量为6000为日本产。
1.3 方法 1.3.1 HCMV抗原的制备感染HCMVAD169株的人胚肺纤维母细胞培养到细胞病变>80%时收集, 灭活处理, -70℃反复冻融3次, 超声破碎, 离心取上清; 蔗糖密度梯度超速离心, 用少量PBS液稀释HCMV, 测定蛋白含量, 加等量体积甘油, - 70℃保存备用。
1.3.2 常规法检测HCMV-IgG和HCMV-IgM抗体诊断试剂由本单位研制, 经一系列实验鉴定, 符合中国生物制品标准化委员会编写的中国生物制品规程中的酶联诊断试剂的基本要求[7]。
1.3.3 HCMV包被抗原与HRP-羊抗人IgG(γ链)和IgM(μ链)工作浓度配比用棋盘滴定法确定工作浓度, 检测时样本稀释液、酶标记物稀释液中加3%PEG[8]。
1.3.4 快速ELISA试剂制备用确定的最佳浓度的抗原每孔50μl加于酶标板孔内, 4 ℃过夜, 次日甩掉多余的液体, 用PBS加吐温-20洗涤液洗1次, 加封闭液100μl(pH7.2、0.01 mmol/LPBS加0.5%牛血清白蛋白), 37℃ 2h。液体甩掉, 室温除湿干燥, 板条密闭包装, 4℃保存。样本稀释液、酶标记物稀释液中除加入加速剂PEG外, 在样本稀释液中还配有能消除IgG、类风湿因子(RF)干扰的试剂羊抗人IgG血清。
1.3.5 快速ELISA法检测程序① 检测HCMV-IgM的加样:在包被好的酶标板孔中滴加1滴(50μl)IgM样本稀释液, 再加稀释好的血清标本10μl(0.4ml生理盐水加10μl血清混匀); ②检测HCMV-IgG的加样:0.4ml生理盐水加10μl血清混匀后, 取50μl加在酶标板相应孔内; ③阴性、阳性对照血清直接加1滴(50μl)于相应孔中; ④ 37℃、15min, 洗板5次, 拍干; ⑤加酶标记物1滴(50μl), 37℃、15min, 洗板5次, 拍干; ⑥加显色剂A液(H2O2)、B液(TMB)各1滴, 37℃、10min; ⑦结果判断:目测出现明显蓝色的孔判为阳性, 无色或淡蓝色为阴性; 用2当量浓度(N)的H2SO4终止反应, 用酶标仪测定各孔OD450值, >2.1 ×阴性对照平均OD值判为阳性, 否则为阴性。
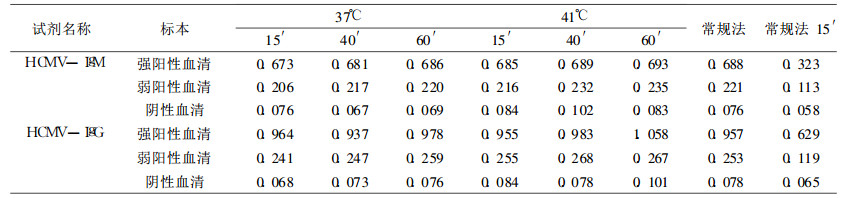
2 结果 2.1 快速ELISA法的反应温度、温育时间的确定含有3% PEG的样本稀释液、酶标记物稀释液应用于检测中, 选择37℃、41℃两种反应温度, 温育时间选择15min、15min; 40min、40min; 60min、60min三种条件, 与常规法(37℃ 40min、40min)及常规法15′(不加PEG, 增加酶标记物含量, 温育为37℃ 15min、15min)对比检测3次, 所得OD值取平均数, 不同条件的实验用各自的最佳试验体系(结果见表 1)。由表 1所示37℃虽然阳性显色趋势略低于41℃, 但其阴性OD值低而且稳定。37℃温育条件下, 用3种不同温育时间检测人HCMV-IgM和HCMVIgG强阳性、弱阳性、阴性混合血清标本的OD值无明显差别, 其与常规法比较也无显著差别; 常规法15′检测的OD值明显低于常规法, 弱阳性标本没有检出(0.113 ÷ 0.058 =1.95 < 2.1, 0.119 ÷ 0.065 =1.83 < 2.1)。因此将ELISA快速法确定为37℃ 15min、15min。
|
|
表 1 不同检测方法中HCMV-IgG、HCMV-IgM的OD值 |
HCMV-IgG和HCMV-IgM抗体阳性血清各1份, 按1 : 50、1: 100、1: 200: 1: 400滴度稀释, 然后做检测, 可得到良好的剂量依赖曲线。
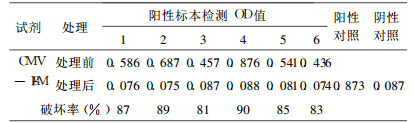
2.2.2 二巯基醇破坏特异性IgM试验取HCMV-IgM抗体阳性血清6份, 按快速ELISA法稀释标本后, 与0.1 mol/L2 -巯基乙醇混合, 37℃作用1h, 再加到已包被了相应抗原的酶标板内进行检测, 结果全部转为阴性, 说明此方法检出的抗体为HCMV感染早期的IgM。结果见表 2
|
|
表 2 2 -巯基乙醇破坏特异性IgM检测结果 |
取HCMV-IgG、HCMV-IgM抗体阳性血清6份, 血清标本按快速ELISA法稀释后, 加入HCMV抗原(0.5mg/mL)混合, 37℃中和30min, 做ELISA检测, 结果测得OD值与对照相比至少减少75%以上, 说明本试剂检测的IgM和IgG为HCMV的特异性抗体。
2.2.4 类风湿因子(RF)对特异性IgM的干扰试验临床上检测RF阳性的血清32份, 应用快速法试剂检测其HCMVIgM抗体, 结果只有1份HCMV-IgM呈阳性; HCMV-IgM阳性血清11份标本, 用RF乳胶凝集试剂检测, 结果没有检测出RF阳性标本, 说明类风湿因子对本试剂干扰不大。
2.3 快速法稳定性试验将快速法的预包被酶标板、阴性和阳性对照血清、样本稀释液、酶标记物、浓缩洗涤液、显色剂、终止液全部试剂放入37℃温箱烤3d后, 与同时4℃存放的试剂盒比较, 每份标本平行测定5次, OD值取平均值, 检测HCMV -IgG、HCMV-IgM的阴性、阳性标本变异系数(CV)分别为8.5%, 7.2%;9.3%, 6.8%, 均小于15%, 说明本试剂稳定性良好。
2.4 快速法精密性测定取HCMV-IgG、HCMV-IgM抗体阳性血清各1份连续测定10孔, 检测的OD值的C.V分别是8.9%、5.4%, 均小于15%。
2.5 快速法不同批号酶联试剂测定用3个不同批次的整套试剂对阳性血清作10次测定, OD值取平均数, 结果HCMVIgG、HCMV-IgM的CV分别为7.1%、8.1%, 均小于15%。
2.6 HCMA感染情况(表 3)|
|
表 3 514例放射工作人员HCMV感染情况 |
用自制的快速HCMV-IgM和HCMV-IgG试剂对放射工作人员血清进行检测。
结果表明, 514例放射工作人员HCMV感染的总阳性率为96.69%(497/514);其中有0.19%(1/514)呈现单项HCMVIgM阳性, 为原发感染; 有2.34%(12/514)IgM和IgG同时阳性为复发感染, 近期感染率为2.53%(13/514), 提示有活动性HCMV感染; 有94.16%(484/514)的HCMV-IgG呈单项阳性, 为既往感染, 也称为潜伏感染。
3 讨论目前检测HCMV-IgM、HCMV-IgG抗体多用间接ELISA法, 该方法温育时间在1h以上, 耗时较长, 不适合快速诊断和流行病学调查。PEG是1, 2 -亚乙基醇聚合而成的一类化合物, 其作为促进剂和增强剂, 可以提高和加速溶液中抗原、抗体复合物的形成, 增强实验的敏感性, 缩短实验时间[9]。本结果发现, 将3%PEG加在样本稀释液和酶标记物稀释液中的快速法与常规法抗原抗体反应效果无明显差别, 但快速法缩短了反应时间。而常规法15′因反应时间短, 特异性抗原抗体没有充分发生反应, 可能会出现弱阳性漏检的情况。此次试验在样本稀释液中同时还加入了特定吸附剂羊抗人IgG, 以消除类风湿因子和特异性IgG干扰而出现的假阳性结果, 从而提高实验的特异性和敏感性。通过二巯基乙醇破坏特异性IgM试验、特异性抗体阻断试验、RF的干扰试验, 均说明快速ELISA诊断试剂特异性好; 一份阳性血清连续检测10次, 得到的OD值变异系数(C.V)均 < 10%, 整套试剂37℃存放3d(相当于4℃存放6个月)后变化率 < 10%。说明本试剂重复性好, 稳定性强。以上结果表明我们研制的快速检测HCMV-IgG、HCMV-IgM的试剂质量良好, 可用于HCMV感染的快速检测和流行病学调查。HCMV是当今世界上列出的严重危害人类健康的十大病毒之一, 可长期潜伏在人体内, HCMV-IgG阳性是既往感染的标志, 也是潜伏的标志, HCMV-IgM抗体阳性是近期感染的标志。由于HCMV是潜伏病毒, 复发感染时体内潜伏HCMV被激活, 特异性IgM抗体可再出现[10]。临床上确诊HCMV感染比较困难, 主要依赖于实验室诊断。我们对514例济南地区放射工作人员血清进行检测, 巨细胞病毒感染的总阳性率为96.69%, 其中94.16%为潜伏感染, 2.14%为复发感染, 0.19%为原发感染, 近期感染率为2.53%, 也就是说514名济南市放射工作人员中有13人有活动性巨细胞病毒感染, 因而会产生HCMV感染而引起的疾病, 应引起高度的重视。
从事辐射工作的放射工作人员, 都或多或少地接受到一些射线, 日久天长易引起血象低, 免疫力功能下降, 目前研究放射工作人员的放射工龄、积累剂量、年剂量与HCMV感染性疾病的发生的关系还是空白, 有待进一步深入研究。
| [1] |
董永绥. 继续深入进行巨细胞病毒的研究[J]. 中华儿科杂志, 1995, 23: 3-4. DOI:10.3760/j.issn:0578-1310.1995.01.005 |
| [2] |
陈晖. CMV感染与糖尿病的关系[J]. 国外医学病毒学分册, 2005, 12(1): 24-27. |
| [3] |
Michaelis M, Kotchetkov R, Vogel Ju, et al. Cytomegalovirus infection blocks apoptosis in cancer cells[J]. CellMol Life Sci, 2004, 61(11): 1307-1316. DOI:10.1007/s00018-004-3417-4 |
| [4] |
Shen YH, Utama B, Wang J, et al. Human cytomegalovirus causes endothelial injury through the ataxia telangiectasia mutant and p53 DNA damagesignaling pathways[J]. Circ Res, 2004, 94(10): 22. |
| [5] |
Reinhardt B, Minisini R, Mertens T. Opinion article:cytom egalovirus is a risk factor in atherogenesis[J]. Herpes, 2002, 9(1): 21-23. |
| [6] |
Altannavch TS, Roubalova K, Broz J, et al. Serological markers of Chlamydia pneum oniae, cytomegalovirus and helicobacter pylori infection in diabetic aand non-diabetic patients with unstable angina pectoris[J]. Cent Eur J Public Health, 2003, 11(2): 102-106. |
| [7] |
中国生物制品标准化委员会. 中国生物制品规程[M]. 北京: 化学工业出版社, 2000.
|
| [8] |
俞建民, 谢忠平, 董承红, 等. PEG沉淀HAV的最佳条件[J]. 中国生物制品学杂志, 1997, 10(1): 52-53. |
| [9] |
Wenz B, Apuzzo J, Shah DP. Evaluation of the polyethylene glycol-potentiated indirect antiglobulin test[J]. transfusion, 1990, 30(4): 318-21. DOI:10.1046/j.1537-2995.1990.30490273439.x |
| [10] |
吕绳敏. 巨细胞病毒感染的实验室诊断[J]. 实用儿科杂志, 1992, 7(2): 67-68. |