头颈部[1]、胸部及其他部位[2]肿瘤患者放疗后, 与放疗前相比T、B淋巴细胞绝对值下降, T淋巴细胞亚群的动态平衡也发生了变化, 造成机体免疫功能降低, 常发生放射性食管炎。癌症患者放疗后细胞、体液免疫功能降低的情况会持续数月或数年, 该现象在经60Co-γ射线照射的小鼠实验中也被进一步证实[3]。这可能是由于放射性射线作用于机体免疫系统, 从而抑制了免疫系统的功能, 该现象可能与放射性食管炎长期难以治愈有关。复方芍根口服液是治疗放射性食管炎的效果较好的中药制剂, 但其作用机制不明确。本研究主要分析了经复方芍根口服液治疗的放射性食管炎大鼠白细胞及细胞和体液免疫指标的变化, 从对免疫系统的影响上阐明复方芍根口服液可能通过对放射性射线损伤的免疫修复作用从而防治放射性食管炎。
1 材料和方法 1.1 实验动物128只清洁级Wistar大鼠, 180 ~ 220g, 雌雄各半。由河北省实验动物中心提供(动物合格证号为DK0512053)。
1.2 药物复方芍根口服液采用中药验方制备, 主要成分为白芍、山豆根、白芨等14味中药。首先用单提法, 后采用少量分次蒸发浓缩法制备中药口服液—复方芍根合剂, 该制剂生药浓度为2.88g /ml, 相对密度约为1.18, 并采用理化鉴别法及薄层色谱法鉴别控制其内在质量。西药治疗药物为盐酸利多卡因(2%, 上海复星朝晖药业公司)、地塞米松(5mg /支, 浙江仙琚制药股份有限公司)、硫酸庆大霉素(4万U/ml, 华北制药集团制剂有限公司)和生理盐水(250ml, 石家庄四药有限公司)。
1.3 主要试剂FITC标记小鼠抗大鼠CD3单克隆抗体(克隆号1F4), 小鼠抗大鼠CD4:FITC-CD8:RPE双标记单克隆抗体(克隆号W3/25, CD8克隆号OX8), (美国Serotec公司产品), 免疫浊度法血清免疫球蛋白IgG、补体C3试剂盒(批号717007)(上海太阳生物技术公司)。
1.4 主要仪器BEZKLAN Coulter AcT diff2型血细胞记数仪(美国Beckman Coulter公司), DR-HW-Ⅰ型电热恒温水温箱(北京西城区医疗器械厂生产), Epics-XLⅡ型流式细胞仪(美国Beckman Coulter公司), 紫外可见分光光度计(北京普析通用仪器有限责任公司), Labofuge 400R低温高速离心机(德国), -80℃超低温冰柜(德国Hettich公司)。
1.5 放射性食管炎动物模型的制作[4]大鼠经60Coγ射线43Gy局部照射后第7天和14天, 所有雌性及雄性大鼠均可出现食管炎病理损伤。
1.6 实验动物的分组及给药方法将放射性食管炎动物模型随机分为预防组、治疗组、单纯照射组并以正常大鼠(不做任何处理)作为对照。预防组和治疗组分别连续用药14d和8d。预防组分为复方芍根口服液正常剂量及大剂量预防组(从放射结束开始给药)。治疗组分为复方芍根口服液正常剂量及大剂量治疗组(从放射结束后第7天给药)和西药治疗组(从放射结束后第7天给药)。单纯照射组分为照射一组和照射二组(从大鼠放射结束后不经任何处理分别于第7和14天处死)。复方芍根口服液正常剂量和大剂量给药量生药浓度分别为0.475 g /ml和1.425 g /ml。大鼠口服西药治疗药物由临床上普遍应用的药物根据药物学用量标准调整用药量[5, 6]。大鼠西药口服液浓度为人用药(NS 250ml, 2%利多卡因20 ml, 地塞米松10mg, 硫酸庆大霉素32万U)浓度的0.16倍。大鼠灌药量为2 ml /次, 3次/日, 间隔6h给药。大鼠服药后, 禁食禁水30min。
1.7 血液标本的采集实验大鼠于各实验点用2%戊巴比妥钠经腹腔麻醉给药(45mg /kg)后采集眼球流出的血液收集入EDTA-K2· 2H2O抗凝管中, 迅速混匀, 用于T淋巴细胞亚群分析及血液分析。从股静脉采血3ml, 3 000r /min离心10min, 留取血清, -80℃保存, 用于血清IgG及补体C3的测定。
1.8 免疫荧光染色取大鼠EDTA-K2抗凝血100μl于两个试管底部, 加入FITC标记小鼠抗大鼠CD3单克隆抗体及小鼠抗大鼠CD4(FITC)-CD8(RPE)双标记单克隆抗体各10μl, 充分混匀, 室温避光染色30min, 进行流式细胞术检验。应用Expo32ADC软件分析并报告出T淋巴细胞(CD3+)、Th细胞(CD3+CD4+CD8-)和Tc细胞(CD3+CD4-CD8+)百分率和绝对数, Th/Tc(CD3+CD4+CD8-/CD3+CD4-CD8+)细胞比值。
1.9 外周血白细胞分析取各实验点大鼠EDTA-K2抗凝血进行白细胞的检测。
1.10 大鼠血清IgG和补体C3含量测定用免疫浊度法检测大鼠血清中的IgG及补体C3含量。
1.11 数据的统计学处理数据均采用SPSS 13.0软件包进行统计学分析。数据比较用One Way ANOV分析, 均数的两两比较采用Student-Newman-Keuls检验。数据结果均以x±s表示, P < 0.05有统计学差异。
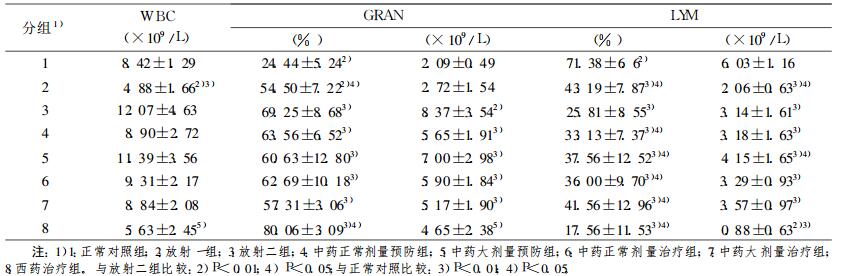
2 结果 2.1 各实验点大鼠外周血白细胞数的分析如表 1结果所示, 与正常组大鼠相比经43Gy射线局部照射后第一周大鼠外周血白细胞总数明显下降(P < 0.001), 第二周与正常组相比差异无显著性(P>0.05)。中药预防及治疗组大鼠外周血白细胞数也在正常范围(P>0.05), 但西药治疗组白细胞数明显低于正常(P < 0.05)。大鼠受到放射性射线照射后一周时中性粒细胞百分率显著升高(P < 0.01), 至第二周时中性粒细胞百分数和绝对值比第一周更为增加(P < 0.05)。放射后大鼠外周血淋巴细胞百分率及绝对值均显著降低(P < 0.01), 淋巴细胞百分率至放射后第14天时降至最低点。经西药治疗后, 与放射2组相比大鼠中性粒细胞百分率明显增加(P < 0.05), 淋巴细胞百分数、绝对值均明显下降(P < 0.01)。中药预防组及治疗组与放射二组相比, 淋巴细胞的百分率明显增加(P < 0.05), 中药口服液大剂量预防组大鼠淋巴细胞绝对值明显增加(P < 0.05)。
|
|
表 1 各实验组大鼠外周血白细胞 |
实验大鼠经43Gy 60Co-γ射线局部照射后第7、14天, T细胞、Th细胞和Tc细胞绝对值均下降(P < 0.01), 。实验大鼠经γ射线照射后第7天时, T细胞、Th细胞和Tc细胞百分率有暂时升高的现象(P < 0.05), 至14天时与正常组差异无显著性(P>0.05)。放射1、2组大鼠与正常组大鼠相比Th/Tc细胞比值差异无显著性(P>0.05)。
2.2.2 复方芍根口服液预防组大鼠T细胞亚群的变化如表 2结果所示, 经复方芍根口服液预防性治疗后第14天时, 正常剂量预防组与放射二组相比, T细胞、Th细胞和Tc细胞绝对值差异无显著性(P>0.05), 但T淋巴细胞百分率明显提高了(P < 0.05), 与正常组相比, Tc细胞百分率明显提高(P < 0.05)。中药大剂量预防组大鼠T细胞、Th细胞和Tc细胞绝对值明显增高(P < 0.001)。
|
|
表 2 各实验组大鼠血T细胞亚群 |
T细胞亚群的变化经复方芍根口服液针对性治疗8d后, 大剂量治疗组与放射二组相比(P < 0.01), T淋巴细胞数量明显增高, 差异有非常显著性(P < 0.01), Th和Tc细胞绝对值(P < 0.05)明显增高。
2.2.4 西药治疗组大鼠外周血T细胞亚群的变化西药治疗组与放射二组相比, 虽然大鼠外周血中T淋巴细胞、Th细胞和Tc细胞绝对值显著降低(P < 0.001), 但是Th淋巴细胞百分率明显升高(P < 0.05), Tc细胞显著降低, 进而显著提高了Th/Tc细胞比值。
2.3 复方芍根口服液治疗对大鼠血清IgG及补体C3含量的影响实验大鼠经43Gy 60Co-γ射线局部照射后第7天、第14天, 血清中IgG及补体C3含量均明显下降(P < 0.01), 但是经复方芍根口服液预防或治疗后, 均不能升高大鼠免疫球蛋白IgG水平, 只有复方芍根口服液大剂量预防组与放射组相比, 提高了补体C3水平, 但未恢复至正常水平。如表 3所示。
|
|
表 3 实验各组大鼠血清IgG和补体C3含量(g /L) |
大量临床资料表明, 恶性肿瘤患者细胞免疫低下[7]、体液免疫功能紊乱[8]。放疗虽然是可抑制肿瘤细胞生长的有效方法, 但会进一步抑制免疫功能[1]。本实验中, Wistar大鼠经射线照射后第14天, 淋巴细胞百分率明显降低。与Fearon [9]报导一致, 本实验中单次43Gy 60Co-γ射线诱导出的放射性食管炎大鼠与正常组大鼠相比, T细胞、Th细胞和Tc细胞绝对值均显著下降(P < 0.001), 这可能是由于大剂量辐射可造成CD3+ T细胞中CD28的表达下降、Fas表达上升, 进而使T细胞DNA断裂增加, 导致细胞凋亡增加, 进而影响免疫功能[10]。机体在抗肿瘤免疫中, T细胞免疫起着主导作用, 主要由CD4+和CD8+T细胞完成。CD4+和CD8+T细胞的数量对于机体杀伤癌细胞至关重要。由于T细胞是辐射最敏感的细胞之一, 放射线对其也容易造成破坏。本研究中, 动物实验结果显示, 放射性食管炎大鼠细胞免疫功能明显受损, 但经大剂量复方芍根口服液预防性治疗及出现食管炎病理变化之后的针对性治疗后, 与单纯放射二组相比, T细胞、Th细胞和Tc细胞绝对值显著提高了。正常剂量复方芍根口服液预防组与放射二组相比, T细胞百分率明显增高。以上结果提示, 复方芍根口服液与细胞免疫的提高具有一定量效比。复方芍根口服液使得细胞免疫的提高有助于放射性食管炎的尽快恢复和增强机体抗肿瘤作用。免疫球蛋白是体液免疫的主要分子。IgG在血清中含量最多是反应机体体液免疫水平的重要指标。补体C3是具有酶活性的球蛋白, 在肿瘤的非特异性体液免疫中具有杀伤肿瘤细胞的作用, 而且能协助抗体和免疫细胞共同杀伤肿瘤细胞[11, 12]。受到辐射损伤的放射性食管炎大鼠食管粘膜上皮脱落, 炎细胞浸润, 免疫球蛋白IgG及补体C3水平低下, 会导致继发性的细菌感染。本实验结果显示, 大鼠经局部60Co-γ射线照射后IgG及补体C3水平均较正常对照组明显下降, 经复方芍根口服液预防性和针对性治疗后, 大鼠IgG水平与放射二组相比差异无显著性, 但大剂量预防组补体C3水平明显提高, 提示复方芍根口服液可能通过加强体液免疫, 对抗食管条件致病菌的致病性。糖皮质激素、抗生素与粘膜麻醉剂为临床上常用的治疗放射性食管炎、缓解疼痛的药物, 联合治疗好转率为72%[13]。西药虽通过抗菌、治疗局部粘膜继发感染、减轻渗出、水肿, 通过使食管粘膜内感觉神经末梢麻痹缓解症状, 但本实验结果显示, 西药治疗组大鼠外周血白细胞总数、淋巴细胞百分数、绝对值明显下降。西药可能是通过对机体免疫细胞数量和功能的抑制, 抑制炎细胞的趋化, 进而控制炎症反应, 促进组织修复。从实验结果提示, 西药的长期应用有可能影响癌症患者抗肿瘤作用。近年来, 随着国家对预防性抗生素使用的严格限制, 除放、化疗白细胞数低于1.0 ×109 /L和放射性溃疡外, 预防性抗生素的使用被视为不合理的使用。
复方芍根口服液是一种防治放射性食管损伤效果较好的药物, 组方中包含多种具有抗肿瘤和提高免疫力的单味中药。本实验结果显示, 复方芍根口服液对放射性食管炎有预防和治疗的作用, 其机制是通过对辐射损伤大鼠细胞免疫及体液免疫的调节作用, 如提高外周血淋巴细胞的百分率、绝对值, 增加T淋巴细胞(CD3+)、Th细胞(CD3+CD4+ CD8-)和Tc细胞(CD3+CD4-CD8+)绝对值, 提高补体C3水平等。该制剂在临床放疗病人中的应用, 不仅可防治放疗并发症, 而且可促进机体的免疫功能, 提高抗癌疗效。
| [1] |
Kuss I, Hathaway B, Ferris RL, et al. Imbalance in absolute counts of Tlymphocyte subsets inpatients with head and neck cancer and its relation to disease[J]. Adv Otorhinolaryngol, 2005, 62: 161-172. |
| [2] |
Santin AD, Bellone S, Palmierim M, et al. Effect of blood transfusion during radio the rapyon the immune function of patient swith cancer of the uterine cerix:role of interleukin-10[J]. Int J Radiat Oncol Biol Phys, 2002, 54(5): 1345-1355. DOI:10.1016/S0360-3016(02)03757-4 |
| [3] |
Pecaut MJ, Nelson GA, Gridley DS, et al. Dose and dose rate effects of whole-body gamma-irradiation:Ⅰ.Lymphocytes and lymphoid organs[J]. In Vivo, 2001, 15(3): 195-208. |
| [4] |
沈莉, 单保恩, 张莉, 等. 实验性放射性食管炎的研究[J]. 中华肿瘤防治, 2007, 14(1). |
| [5] |
祝爱峰, 闫向远, 任军华, 等. 中西医结合治疗放射性食管炎的体会[J]. 中华放射肿瘤学杂志, 2003, 12: 58. |
| [6] |
施新猷, 王四旺, 顾为望, 等. 比较医学[M]. 西安: 陕西科学技术出版社, 2003: 695-808.
|
| [7] |
Lissoni P, Brivio F, Ferrante R, et al. Circulating immature and mature dendritic cells in relation to lymphocyte subsets in patients with gastrointestinal tract cancer[J]. Int Biol Markers, 2000, 15: 22-25. DOI:10.1177/172460080001500104 |
| [8] |
成国建. 食管癌患者血清免疫球蛋白与补体C3测定对放射治疗预后分析[J]. 肿瘤基础与临床, 2006, 19(1): 38-39. DOI:10.3969/j.issn.1673-5412.2006.01.016 |
| [9] |
Kajioka EH, Gheorqhe C, Andres ML, et al. Effects of proton and gamma radiation on lymphocyte populations and acute response to antigen[J]. In Vivo, 1999, 13(6): 525-533. |
| [10] |
Walker LSK, Maleod JD, Boulougouris G, et al. Down regulation of CD28 via Fas(CD95):influence of CD28 on T-cell apoptosis[J]. Immunol, 1998, 94: 41-47. |
| [11] |
Fearon ER, Cho KR, Nigro JM, et al. Identification of a chromosome 18 q gene that is altered incolorectal cancers[J]. Science, 1990, 247(4938): 49-56. DOI:10.1126/science.2294591 |
| [12] |
Satto T, Shimoda K, Kinoshita T, et al. Prediction of oper-active mortality based on impairment of host defense systems in patients with esophageal cancer[J]. J Surg Oncol, 1993, 52(1): 1-8. DOI:10.1002/(ISSN)1096-9098 |
| [13] |
杨海华, 王建华, 丁维军. 2级急性放射性食管炎治疗中抗生素的作用分析[J]. 浙江临床医学, 2006, 8(2): 205. DOI:10.3969/j.issn.1008-7664.2006.02.086 |