研究表明, 急性电磁辐射具有明确的中枢神经损伤效应[1, 2]。但电磁辐射作为一种物理刺激因素是如何通过细胞信号传导系统来影响神经细胞功能活性的呢?相关机理的研究有待深入。近年来的研究发现, AMPA受体是存在于神经细胞内和细胞膜上参与神经细胞信号传导的一类重要受体[3]。AMPA受体包括GluR1、GluR2、GluR3和GluR4等, 其中主要是GluR2通过其磷酸化的形式参与神经信号的传导[4]。本实验通过检测电磁辐射后PC12细胞GluR2的蛋白质表达及其磷酸化水平的变化, 探讨GluR2的磷酸化与电磁辐射致中枢神经细胞损伤之间的关系。
1 材料与方法 1.1 主要仪器和试剂CO2培养箱(Harris, USA), 电磁辐射源(西安黄河厂); 低温超速离心机(Biofuge22R Heraeus, Germany); 电子天平(Sartorious, USA); 紫外分光光度计(Du-640 Beckman, USA); 垂直电泳槽及电泳仪(Bio-Rad, USA); 蛋白转印槽(Bio-Rad, USA); 凝胶成像系统(Doc Gel200, Bio-Rad, USA); PC12细胞株由中国科学院药物研究所提供, 抗GluR2兔多克隆抗体(Santa Crus); 抗磷酸化GluR2(Ser880 / 831)多克隆抗体(Santa Crus); 辣根过氧化物酶标记的山羊抗兔二抗(北京中山)。
1.2 PC12细胞培养PC12细胞1 ×105个/ml浓度接种于RPMI 1640培养液中, 内含10 %小牛血清、10 ×104 U / L青霉素、10 ×104 U / L链霉素, 置于37 ℃, 5 % CO2培养箱中培养, 3 ~ 4 d后细胞处于对数生长期, 用于实验。细胞培养瓶及培养板均预先以多聚赖氨酸处理。
1.3 实验分组将生长良好的PC12细胞随机分为对照组(0 mW /cm2, 20 min)和电磁辐射组(90 mW /cm2, 20 min), 各组又分为辐照后0 h、3 h、12 h和24 h四个时相点。
1.4 电磁辐射系统将PC12细胞置于反射系数近似为零的微波暗室内, 以平均功率密度为90 mW /cm2的电磁波进行一次性辐照20 min。暗室环境温度及湿度由空调器、除湿机等调节保持恒定, 温度稳定于(20 ±2) ℃, 相对湿度稳定于(60 ± 10) %。
1.5 Western2blot检测PC12细胞GluR2蛋白质表达及其磷酸化水平于相应时相点将培养细胞离心提纯, 以蛋白裂解液匀浆提取蛋白, Lowry法进行蛋白质定量。制备10 %分离胶和5 %的脓缩胶, 以40μg总蛋白上样后进行电泳(100 V, 150 min), 然后转印至聚偏二氟乙烯(PVDF)膜上, 封闭2 h, 一抗4 ℃孵育过液(稀释比例1: 200), 洗涤3次, 辣根过氧化物酶标记的山羊抗兔二抗(稀释比例1: 500) 37 ℃孵育1 h, 洗3次, 最后联苯二胺(DAB)显色, 显色条带在Bandscan分析软件上测定灰度值, 并进行定量分析, 每次实验重复6次。
1.6 统计学处理实验数据采用Microsoft Excel软件进行方差齐性检验和t检验, 实验结果用x±s表示。
2 结果 2.1 电磁辐射后PC12细胞一般情况观察经90 mW / cm2电磁波辐照后12 h以内PC12细胞形态无明显变化, 在辐照后24 h PC12细胞的部分细胞突起回缩, 少数细胞脱落, 悬浮于培养液中。每瓶PC12细胞在辐照后均测试其培养液的温度, 平均温度为(36.7 ±0.4) ℃, 较培养箱温度约低0.8 ℃。
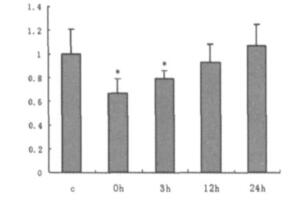
2.2 电磁辐射后PC12细胞GluR2的蛋白质表达水平电磁辐射后0 h和3 h组PC12细胞GluR2的蛋白质表达水平较对照组降低(P < 0.05), 12 h和24 h组无显著变化(见图 1、2, 表 1)。

|
图 1 电磁辐射后各时相点PC12细胞GluR2的蛋白质表达水平的western blot结果图 |
|
图 2 电磁辐射后各时相点PC12细胞GluR2的蛋白质表达水平的平均结果图 |
|
|
表 1 电磁辐射后各时相点PC12细胞GluR2的蛋白质表达水平的平均结果(n =6, x±s) |
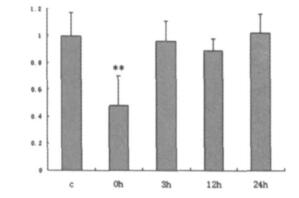
电磁辐射后0 h组PC12细胞GluR2的蛋白质磷酸化水平较对照组显著降低(P < 0.01), 3 h、12 h和24 h组无显著变化(图 3、4, 表 2)。

|
图 3 电磁辐射后各时相点PC12细胞GluR2的蛋白质磷酸化水平的western blot结果图 |
|
图 4 电磁辐射后各时相点PC12细胞GluR2的蛋白质磷酸化水平的平均结果图 |
|
|
表 2 电磁辐射后各时相点PC12细胞GluR2的蛋白质磷酸化水平的平均结果(n=6, x±s) |
神经科学研究表明, 小脑不仅是维持机体平衡的重要器官, 也是运动性学习记忆的主要功能脑区[5]。蒲肯野氏细胞是小脑皮层唯一的传出性神经元, 在小脑学习记忆过程中起核心作用[6]。突触长时程抑制(long term depression, LTD)是小脑运动性学习记忆功能的神经基础[7], 蒲氏细胞突触后膜上的GluR2是LTD形成过程中最为关键的蛋白质分子[8]。GluR2通过自身的磷酸化改变, 将神经信号从突触前膜传递到突触后膜, 并最终形成学习记忆[9]。本实验使用的PC12细胞模型是被广泛用于研究神经细胞功能活性的一种细胞模型。实验结果显示, 电磁辐射后GluR2的蛋白质表达水平有所下降, 而GluR2的蛋白质磷酸化水平更是出现显著降低, 说明本实验的电磁辐射剂量对PC12细胞造成了损伤, 这种损伤在蛋白质的磷酸化水平更为严重。由于GluR2的磷酸化是GluR2完成神经信号传导的重要生理变化, 根据本实验结果, 我们推测电磁辐射对GluR2磷酸化过程的破坏将使小脑无法形成正常的LTD, 从而导致小脑运动性学习记忆功能障碍。这一推测有待于进一步的研究证实。
| [1] |
Lai H, Horita A, Guy AW. Microwave irradiation affects radial-arm maze performance in rat[J]. Bioelectro-magnetics, 1994, 15(2): 95-104. DOI:10.1002/(ISSN)1521-186X |
| [2] |
杨学森, 龚茜芬, 张广斌, 等. 电磁辐射对大鼠学习记忆和海马神经元的影响[J]. 解剖学研究, 2004, 26(4): 261-264. DOI:10.3969/j.issn.1671-0770.2004.04.008 |
| [3] |
Wataru Kakegawa, Michisuke Yuzaki. Amechanism underlying AMPA receptor trafficking during cerebellar long-term potentiation[J]. PNAS, 2005, 102(49): 17846-17851. DOI:10.1073/pnas.0508910102 |
| [4] |
Jordan PS, Kogo T, Ying S, et al. Targeted In Vivo Mutations of the AMPA Receptor Subunit GluR2 and Its Interacting Protein PICK1 Eliminate Cerebellar Long-Term Depression[J]. Neuron, 2006, 49: 845-860. DOI:10.1016/j.neuron.2006.02.025 |
| [5] |
David JL. Neuroscience:from molecules to memory in the cerebellum[J]. Science, 2003, 301: 1682-1685. DOI:10.1126/science.1090462 |
| [6] |
John PW, Hidetoshi Y, Zeng XH, et al. Normalmotor learning during pharmacological prevention of Purkinje cell long-term depression[J]. PNAS, 2005, 102(47): 17166-17171. DOI:10.1073/pnas.0508191102 |
| [7] |
Koekkoek SKE, Hulscher HC, Dortland BR, et al. Cerebellar LTD and learning-dependent timing of condition edeyelid responses[J]. Science, 2003, 301: 1736-1739. DOI:10.1126/science.1088383 |
| [8] |
Tanaka H, Grooms SY, Bennett MV, et al. The AMPA Rsubunit GluR2:still front and center-stage[J]. Brain Research, 2000, 886: 190-207. DOI:10.1016/S0006-8993(00)02951-6 |
| [9] |
Hee JC, Jordan PS, Richard LH, et al. Requirement of AMPA receptor GluR2 phosphorylation forcerebellar long-term depression[J]. Science, 2003, 300: 1751-1755. DOI:10.1126/science.1082915 |




