2. 南通大学实验动物中心;
3. 中国医学科学院放射医学研究所
在用细胞进行放射肿瘤学方面研究时, 射线照射后的活细胞数目及细胞存活分数是两个重要的检测指标[1]。目前获得活细胞数目有台盼蓝染色后用倒置显微镜计数和流式细胞仪检测等, 再经过计算可获得细胞存活分数, 而MTT分析可以直接获得细胞存活率[2]。为了研究这三种方法对同一样本检测结果的差异, 笔者用人乳腺癌细胞MCF-7进行了实验。
1 材料和方法 1.1 材料人乳腺癌细胞MCF-7(由中国科学院上海生科院细胞资源中心提供); MTT(商品名噻唑蓝, 由联星生物公司提供); 0.25%胰蛋白酶; RPMI-1640培养液(含12%胎牛血清, 青、链霉素, 0.005%胰岛素); 二甲基亚砜(DMSO, 分析纯); Siemens公司KD-2型加速器; 516MC型酶联免疫分析仪(上海第三分析仪器厂); 贝克曼库尔特公司EPIC5-XL型流式细胞仪; COIL-4355型倒置显微镜。
1.2 细胞培养及照射将MCF-7细胞常规培养, 取指数生长期细胞, 用细胞培养液制成单细胞悬液以每瓶1.5×105个细胞接种到10个培养瓶中, 作为10组样本, 分别照射不同的吸收剂量, 照射时采用6MVX射线, 源皮距为100cm, 射野为10cm×10cm, 总吸收剂量为15Gy, 其中5组分次剂量间以等比K变化, 其等比取值为:0.9、0.95、1.02、1.05、1.1;4组分次剂量间以等差δ变化, 等差取值为-0.15 Gy、-0.1 Gy、0.1 Gy和0.15 Gy; 1组采用每天照射1.5 Gy的照射方案。照射过程中每天集体换培养液一次。
1.3 细胞数目及检测细胞存活率计算照射完毕后的细胞用胰酶消化, 离心, 每瓶单独制备单细胞悬液10ml, 总计10个样本, 分别用下述三种方法进行检测并进行数据处理:①台盼蓝染色计数:取9滴细胞悬液移入小试管, 加一滴0.4%台盼蓝溶液, 混匀; 在3min内, 用血球计数板在倒置显微镜下(10×物镜)观察计数板四角四个大方格中的细胞数目, 分别计数活细胞和死细胞以获得最后待测样本中活细胞比例(重复测3次求平均值), 由于预实验确定MCF-7细胞的倍增时间为58.9h, 由计算可知未经照射的1.5×105个初始接种细胞经过同样时间培养后数目为1.9×106个, 因此某种方案照射后的细胞存活率S由式(1)计算:
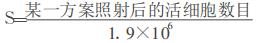
|
(1) |
② 流式细胞仪分析:取约3ml的细胞悬液, 离心弃去上清液。洗涤2次(加3ml Annexin V Binding缓冲液, 轻轻混匀, 1000r/min, 5min, 弃上清), 加500μl缓冲液, 将沉淀细胞轻轻吹打均匀。吸取100μl混悬液至5ml试管, 加5μl Annexin V-FITC和5μl PI, 轻轻混匀, 置暗处25℃15min, 加500μl缓冲液到每一管, 用流式细胞仪一小时内检测获得样本中活细胞比例(重复测3次求平均值), 而某种方案照射后的S值也由式(1)计算。③MTT分析:取每组的单细胞悬液, 用加样器每瓶取6份接种于96孔板中, 每份200μl; 另取6孔作为调零孔, 每孔加入200μl培养液。另取1.9×106个未经照射的细胞制备成10ml的单细胞悬液作为未照射组, 取6份, 每份200μl接种到96孔板中; 将96孔板移入培养箱, 在37℃, 5% CO2+95%空气, 高湿度条件下培养24h, 弃去培养液, 每孔加入20μl MTT, 继续培养4h, 弃去多余的MTT溶液, 每孔加入150μlDMSO, 轻微振荡10min, 使结晶物充分溶解, 应用酶联免疫分析仪490nm光谱测量每孔的吸光度A值。最后给出的每孔吸光度A值均已经过调零处理, 即已减去了调零孔A值读数的平均值, 而最后某一照射方式获得的细胞存活率S由式(2)计算:

|
(2) |
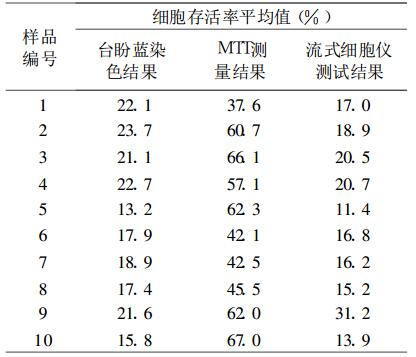
用台盼蓝染色计数及流式细胞仪测试所获得的各待测样本中的活细胞数目及比例如表 1所示。可以看出, 对于所测试的10个样本, 两种方法获得的结果有差异, 其活细胞比例相差幅度在1.9%~22.3%之间变化。基本上流式细胞仪测试获得的数据要小于台盼蓝染色计数获得的结果。其原因可能是因为在上述两种方法测试时, 流式细胞仪测试前的准备步骤要比台盼蓝染色计数的准备步骤复杂得多, 准备时间也要长得多, 要多2次离心和洗涤, 而步骤的增加和处理时间的延长都可能会导致活细胞的死亡, 从而导致两种方法测试结果的差异。
|
|
表 1 两种测试方法分别获得的最后待测样本中的活细胞比例 |
由MTT方法测量获得的某一方案照射后的S值及其他两种方法测量获得活细胞数目再经过计算所获得同一样本的S值结果如表 2所示。可知, 三种方法所获得的S值也存在差异, 基本上从流式细胞仪测试结果获得的S值最低, 从台盼蓝染色计数结果获得的S值次之, 而MTT测量结果获得的S值最大, 而且与其他两种方法计算获得的结果差距较大, 甚至有几倍差距。其原因可能是因为用台盼蓝染色计数及流式细胞仪测试结果计算获得S值时, 其分母是根据初始接种数目并通过倍增时间计算获得的一定时间后的活细胞数目, 而MTT实验过程中, 初始数目的细胞要接种到96孔板中总计培养28h左右, 接种细胞肯定不可能完全贴壁存活, 部分细胞可能会发生凋亡或丢失, 造成计算时分母偏小, 从而造成最后获得的S值变大。而且, 由于台盼蓝染色计数及流式细胞仪测试时均要经过胰酶消化和离心过程, 其间肯定也会有一部分活细胞死亡或丢失从而导致式(1)中分子的变小, 而MTT方法检测时由于照射组和对照组均经过相同的处理, 虽然可能也会导致细胞死亡, 但由于对分子分母的受到相似影响, 因此不会造成对最后结果产生大的影响。另外, 从MTT测试获得细胞存活率的前提是待测样本中细胞数目与吸光度A值成线性关系, 但从文献及我们实验获得的两者关系来看大体上呈弧线形, 即该曲线斜率在缓慢降低[3, 4]。而细胞存活率是某一样本的A值与对照组A值的比值, 因此, 由于对照组细胞密度高, 而样本的细胞密度低, 两者处于曲线的不同部位, 细胞数目与吸光度A值的比例关系也发生了变化, 即高的细胞数目所对应的A值会比严格意义上的线性关系要低, 因此会导致MTT测试获得的S值变大。上述原因可能导致台盼蓝染色计数及流式细胞仪测试结果偏小, 而造成MTT结果偏大, 因此共同导致了三种测量结果间的差异较大。
|
|
表 2 通过计算获得的不同方案照射后各样本的细胞存活率 |
纵上所述, 由于MTT方法不能获得某一待测样本的活细胞数目或活细胞比例, 只能通过与对照组吸光度A值比值获得某一方式处理后的总的细胞存活率。而台盼蓝染色结果及流式细胞仪测试结果中的某一待测样本的活细胞数目或活细胞比例是可以直接获得的, 但某一方式处理后的总的细胞存活率是通过计算获得的。因此, 三种方法的使用要根据实验的具体要求确定。另外, 由于本实验过程历时较长未能重复几次, 所以不能对三种方法检测结果进行统计学处理, 因此, 笔者给出的是单次实验获得的结果, 而这些结果间差异的统计学意义仍需更多实验研究。
| [1] |
刘泰福主编.现代放射肿瘤学[M].上海: 复旦大学出版社上海医科大学出版社, 2001.3-21.
|
| [2] |
司徒镇强, 吴军正主编.细胞培养[M].西安: 世界图书出版社, 1996.
|
| [3] |
Price P, McMillan TJ. Use of Tetrazolium assay in measuring the response of human tumor cells to ionizing radiation[J]. Cancer Res, 1990, 50: 1392-1396. |
| [4] |
缪旭东, 鞠永健, 张良安, 等. SMMC7721肝癌细胞不等分次剂量照射后效果的实验研究[J]. 中华放射医学与防护杂志, 2004, 24: 523-524. DOI:10.3760/cma.j.issn.0254-5098.2004.06.013 |