烟酰胺是近年来国内外研究较多的放射增敏剂, 经研究发现, 它对体外培养的恶性肿瘤细胞以及对人类恶性肿瘤移植瘤均有明显的放疗增敏作用, 而且毒性低[1, 2]。9402号是以烟酰胺为母体化合物合成的烟酰氨基酸类化合物, 其放射增敏作用比母体化合物烟酰胺效果更好, 而且毒性更低。为了观察9402号对正常组织是否有增敏作用, 我们研究了9402号对小鼠小肠隐窝上皮细胞的增敏作用。
1 材料与方法 1.1 实验动物昆明种小鼠, 由中国医学科学院实验动物研究所提供, 体重18~22g。许可证号:SCXK京2004-0001。
1.2 药物9402号药(N-烟酰基-L-天门冬氨酸), 为白色块状晶体, 含量大于99%, 熔点182~191℃。由中国医学科学院放射医学研究所药物室合成。
1.3 照射条件60Co γ射线, 全身照射, 剂量率81.79cGy/min。
1.4 给药及实验分组实验分为单纯照射组, 加药照射组和正常对照组。照射剂量分别为7Gy, 9Gy, 11Gy, 13Gy, 和15Gy, 每一剂量组8只小鼠。照射前40min, 加药照射组腹腔注射9402号1000mg/kg(生理盐水稀释), 照后3.5d断颈处死小鼠取小肠(幽门下3cm处取2cm长度, 分5段, 每段做3张切片), 10%福尔马林固定后石蜡包埋, HE染色。
1.5 实验结果的评价方法按Withers HR方法[3]镜下计数小肠隐窝数。隐窝再生标准为:隐窝细胞数>10个、核大、胞浆少、嗜碱性明显以及有核分裂象、细胞呈密集状。不能再生的隐窝为无细胞或细胞分散、增大、胞浆嗜酸性。
1.6 统计学处理全部实验数据用origin软件处理拟合作图, 求增敏比。
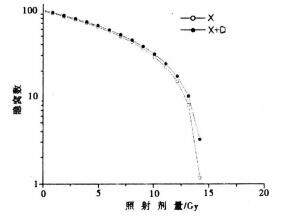
2 结果正常组小鼠小肠肠环组织切片可见小肠绒毛尖耸致密, 排列有序, 隐窝深遂, 腺体丰富。绒毛上皮细胞整齐, 形态正常。照射后, 由于隐窝底部的干细胞失去增殖能力, 绒毛上皮变性肿胀, 胞浆空泡, 胞核崩解。照后3.5d处死小鼠开腹取材, 镜下可见照射组和加药照射组自11Gy起肠管明显充血, 水肿, 肠壁变薄, 随照射剂量的加大, 上述改变逐渐加重, 两组小鼠肉眼检查所见差别不大。镜下7Gy组小肠隐窝上皮细胞与正常组无明显差别, 随照射剂量的增大, 小肠粘膜绒毛逐渐变短, 存活隐窝上皮细胞数量逐渐减少直到绒毛变平, 消失。照射组和加药照射组小鼠小肠再生隐窝数量的变化见表 1。根据所得数据, 得出照射组及加药照射组的剂量生存曲线如图 1所示, 两条曲线的直线部分斜率之比为((6.779/6.6518), 增敏比(SER)为1.02。对两条剂量生存曲线的直线部分进行回归分析, 得出加药照射组回归方程为Y=6.6518X+96.878(Y为再生隐窝数, X为照射剂量, 单位:Gy, r=0.96113), 照射组的回归方程为Y=6.779X+96.725(r=0.96291)。
|
|
表 1 每个肠圈再生隐窝数(x±s) |
|
图 1 照射组和加药照射组的剂量生存曲线 |
理想的增敏剂为即能增强对肿瘤细胞的辐射敏感性, 而又对正常组织无明显毒性, 因为在放疗中, 照射视野内也包括有部分正常组织, 因此在研究增敏剂对肿瘤细胞增敏作用的同时, 也应对正常组织的效应做出评价。为了提高肿瘤细胞的辐射敏感性, 国际上从上世纪60年代起研究放射增敏剂, 已获得一些增敏效价很高的药物, 并试用于临床, 如硝基咪唑类化合物MISO等, 但由于存在明显的毒副作用, 且有效剂量与中毒剂量接近, 从而限制了其在临床上的应用[4, 5]。
烟酰胺是近年来国外研究较多的放射增敏剂, 毒性低, 放射增敏作用显著, 现已进入三期临床试用阶段。9402号是以烟酰胺为母体化合物合成的烟酰氨基酸类化合物, 9402号对肿瘤细胞的增敏作用已经肯定, 但对正常组织是否有增敏作用, 本实验主要观察9402号与辐射联合应用对小鼠小肠隐窝的影响。
小肠隐窝上皮细胞是哺乳动物体内更新最快, 也是对电离辐射最敏感的组织之一。Quastler等通过大量实验证明, 当全身1次照射的剂量超过导致100%死亡的剂量时, 动物的死亡时间一般在3.5d左右, 即使剂量再增加10倍, 动物死亡时间也不会改变, 小肠隐窝可在动物死亡之前出现再生, 由于小肠上皮细胞的这些生物学特点, 我们选在照后3.5d断颈处死小鼠, 制作小肠组织切片, 镜下观察不同剂量点单纯照射组和加药照射组小鼠小肠再生隐窝数, 研究结果表明, 各剂量点单纯照射组小肠再生隐窝数与加药照射组相比, 差异均无显著性(P>0.05), 这与小肠切片的形态观察结果也相一致。9402号与60Co γ射线联合作用, 对小鼠小肠隐窝上皮细胞的增敏比为1.02, 其增敏比明显低于对肿瘤细胞的增敏比, 表明9402号对正常小肠粘膜隐窝上皮细胞无明显增敏作用, 这可能与正常小肠隐窝上皮细胞与肿瘤细胞的含氧量不同有关。目前这方面所做工作不多, 今后我们还将继续对几种正常组织(如皮肤等)进行观察研究, 从而得出比较客观的最后评价。
| [1] |
Fenton BM, Lord EM. Enhancement of tumor perfusion and oxygenation by carbogen and nicotinamide during single and multifraction irradiation[J]. Radiat Res, 2000, 153(1): 75-83. |
| [2] |
Bussink J, Kaanders JH. Vascular architecture and microenvironmental parameters in human squamous cell carcinoma xenografts: effects of carbogen and nicotinamide[J]. Radiother Oncol, 1999, 50(2): 173-84. |
| [3] |
Withers HR. Microcolony survival assay for cells of mouse intestinal mucosa exposed to radiation[J]. Int J Radiat Biol, 1970, 3: 261. |
| [4] |
Murayama C. Radiosensitization of hypoxic Hela S cells in vitro by a new type of radiosensitizer:Spermine and permidine amides with nitro groups[J]. Int J Radiat Biolphys, 1983, 44(5): 497. |
| [5] |
Dische S. MISO spnidazole in the clinic at Mount Vernou[J]. Cancer Clinical Trials, 1980, 3(2): 175. |



