2. 江苏省肿瘤医院;
3. 第三军医大学全军复合伤研究所
随着放化疗在神经系统原发或转移性肿瘤治疗中的广泛应用, 电离辐射导致的中毒性脑白质病呈逐渐增多的趋势。中毒性脑白质病表现为注意力不集中、健忘、性格改变、痴呆、昏迷、甚至死亡, 严重影响肿瘤治疗疗程的顺利进行以及康复期的生活质量[1]。氨基酸是中枢神经系统重要的神经递质或神经调质, 大致可分为兴奋性以及抑制性神经递质两大类。其中谷氨酸(glutamate, Glu)介导兴奋性突触传递, 突触间过量的Glu会引起神经元损伤甚至死亡, 称为Glu兴奋毒性。研究表明, Glu兴奋毒性在中枢神经系统缺血、创伤及神经退行性疾病的神经元死亡中起着重要作用[2]。而牛磺酸对缺血、惊厥等引起的神经元损害具有对抗作用。本实验拟研究电离辐射作用后大鼠脑皮质内Glu、Tau水平和Glu阳性神经元的变化及意义。
1 材料与方法 1.1 实验动物45~50 d龄的成年Sprague-Dawley雄性大鼠45只, 每只重200~250 g, 由第三军医大学实验动物中心提供, 动物(饲料)许可证号SCXK-(军)2002007, 动物实验设施许可证号SCXK-(军)2002-032。在昼夜交替、室温20 ~23 ℃的环境中饲养, 自由饮水、进食。
1.2 实验分组、屏蔽、照射处理大鼠适应环境3 d后, 随机分3组:正常对照组; 10 Gy头部照射组; 20 Gy头部照射组; 屏蔽:动物3%戊巴比妥钠溶液腹腔麻醉后固定体位, 用5 cm ×8 cm ×16 cm两块铅砖重叠自颈部屏蔽下半身; 照射:用第三军医大学辐照中心60Coγ射线一次性照射, 源距100 cm, 剂量率68.46 cGy/min, 吸收剂量分别为0、10、20 Gy, 室温下进行。
1.3 检测方法 1.3.1 脑皮质谷氨酸、牛磺酸水平测定在照射12 h后, 每组取大鼠5只, 断头处死, 迅速取大脑皮质约100 mg, 准确称量后置于匀浆器中, 按比例加入10%磺基水杨酸, 冰浴匀浆, 取出匀浆液立即离心(15 000 rpm 4 ℃离心20 min), 取上清液冻存, 待分析。用Beckman公司的6 300黄金系列氨基酸分析仪601黄金系统色谱工作站定量分析谷氨酸、牛磺酸含量(Glu、Tau标准品为Sigma产品)。色谱条件:色谱柱:Beckman氨基酸分析锂柱(10 cm×4.0 mm); 流动相:Li -A、Li -C、Li -R, 流速10 ml/h; 茚三酮显色剂:流速10 ml/h; 柱温:33.5 ℃; 进样量:50lμ/次; 比色波长:570 nm。
1.3.2 神经细胞内钙离子水平测定在照射12 h后, 每组取3只, 断头取脑, 分离大脑皮层单细胞[3]。用2 μmol/L Fluo-3 AM及0.1% F-127 (Biotium产品)37 ℃负载45 min, 再用Neurobasal培养基(GIBCO产品)充分洗涤盖玻片3次, 充分洗掉未进入细胞内的荧光探针, 并继续在37 ℃保持30 min, 以利于进入细胞内酯化的Fluo-3/AM水解。激光共聚焦显微镜下测量各组细胞内游离Ca2+浓度([Ca2+]i)。
1.3.3 免疫组织化学结合激光扫描共聚焦显微镜检测Glu阳性神经元照射后24 h, 以0.3%戊巴比妥钠腹腔麻醉(20 mg/kg), 开胸, 经左心室用200 ml 4 ℃预冷40 g/L多聚甲醛灌注15 min, 取脑固定。脱水、透明、石蜡包埋, 连续切片(片厚6 μm)。脱蜡, 切片经0.01 mol/L PBS漂洗, 微波修复10 min, 甲醇/H2 O2 (9:1)室温封闭15 min; 入1 %牛血清白蛋白/0.5 %TritonX -100 37 ℃孵育30 min; 含5%-10%正常羊血清PBS孵育10 min; 加入1:1 000稀释的第一抗体(兔抗大鼠Glutamate:Sigma产品) 37 ℃孵育2 ~3 h; 加入1:200 FITC标记的第二抗体(羊抗兔IgG, 北京中杉产品), 室温30 min; 用甘油和0.5MpH为9.0 ~ 9.5的碳酸盐缓冲液的等量混合液作封裱剂封片。激光扫描共聚焦显微镜(Leica TCS -NT型, 德国)观察, 测定单位面积(mm2)阳性细胞核数及相对荧光强度, 激光光源为12 W氩离子激发器, 可激发波长488、514 nm。对照实验:用PBS代替第一抗体溶液孵育切片, 其余步骤同上, 作为免疫组织化学反应的阴性对照, 用以检测免疫组织化学反应的特异性。
1.3.4 细胞凋亡检测按TUNEL原位凋亡检测试剂盒(Roche产品)说明进行。阳性对照用DNA酶(25 mg/ml)室温处理5 min, 阴性对照采用标记液(无TdT)代替TUNEL反应混合物。显微镜下计数每张切片随机计数10个视野的的TUNEL阳性细胞, 每组3张切片平均。同一实验重复3次结果平均。结果用细胞凋亡率表示, 其算式如下:

|
实验数据用x±s表示, 经SPSS软件进行方差分析, 采用卡方检验。
2 结果 2.1 电离辐射对脑皮质内氨基酸含量影响电离辐射后12 h测定脑皮质氨基酸含量(表 1), 结果表明, 随着照射剂量的增大, 脑皮质兴奋性氨基酸Glu含量呈现增加的趋势, 而抑制性氨基酸Tau则随着照射剂量的增大逐渐减少, Glu/Tau比值逐渐上升, 与照射剂量之间存在一定的剂量-效应关系(P < 0.01)。
|
|
表 1 电离辐射后脑皮质内氨基酸含量的改变 |
电离辐射后12 h, 用Ca2+荧光标记探针Fluo-3/M标记脑皮质神经元, 在激光共聚焦扫描显微镜下观察, 通过测定细胞内荧光的强弱来间接反映细胞内Ca2+浓度的大小(表 2, 图 1), 结果显示, 随着照射剂量的增大, 神经元内[Ca2+]i呈现逐步增加的趋势, 且荧光强度的增加与照射剂量之间存在一定的剂量-效应关系; 与脑皮质内兴奋性氨基酸Glu含量增加相一致(P < 0.01)。
|
|
表 2 电离辐射对脑皮质神经元内[Ca2+]i水平的影响 |

|
图 1 电离辐射后大鼠脑神经元内[Ca2+]i的变化 |
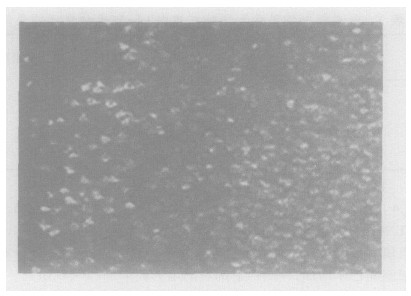
照射后24 h, 用免疫组织化学结合激光扫描共聚焦显微镜检测Glu阳性神经元(表 3, 图 2、3、4), 结果显示, 电离辐射作用后, 大鼠脑皮质浅层Glu阳性神经元呈弥漫性分布, Glu阳性神经元数量增加, 细胞内相对荧光强度显著增强, 与照射剂量之间存在一定的剂量-效应关系(P < 0.01)。
|
|
表 3 电离辐射作用后大鼠脑皮质内Glu阳性神经元的变化 |

|
图 2 0 Gy辐射后大鼠脑皮质谷氨酸阳性神经 |

|
图 3 10 Gy辐射后大鼠脑皮质谷氨酸阳性神经元 |
|
图 4 20 Gy辐射后大鼠脑皮质谷氨酸阳性神经元 |
照射后24 h, 用TUNEL法检测脑皮质神经细胞凋亡情况(表 4), 结果显示, 电离辐射作用后, 大鼠脑皮质内TUNEL阳性细胞呈弥漫性分布, 细胞凋亡率增加, 并随照射剂量的增大而增加(P < 0.01)。
|
|
表 4 电离辐射作用后大鼠脑皮质内神经细胞凋亡的变化 |
随着放化疗在神经系统原发及其转移肿瘤治疗中的广泛应用, 电离辐射导致的中毒性脑白质病呈逐渐增多的趋势。晚期放射性脑损伤的病理学改变表现为白质坏死和脱髓鞘, 而这些改变的发生机理, 特别是在急性和亚急性期的病理生理学过程至今所知不多。随着放射治疗疗效的提高和诊断手段的更新, 肿瘤患者对生存期生活质量要求日益迫切, 对放射性脑损伤防护的研究更有意义[4]。
氨基酸是中枢神经系统重要的神经递质或神经调质, 大致可分为兴奋性以及抑制性神经递质两大类。兴奋性氨基酸(EAA)包括Glu的兴奋毒性参与了脑卒中、创伤、癫痫、慢性神经变性性疾病等的神经元死亡[5]。现已明确, Glu的兴奋毒性是Glu在突触间的过量释放及对突触后神经元的进一步激活。其作用机制为:过量释放的Glu激活突触后膜上的谷氨酸受体, 引起相应的离子通道开放, 影响Na+、Cl-、Ca2+等的跨膜流动, 主要导致细胞内Ca2+浓度升高(称为细胞内Ca2+超载), 过量的Ca2+激活细胞内Ca2+依赖的信号级联途径, 最终导致神经细胞死亡。其中, 细胞内Ca2+超载是Glu兴奋毒性引起神经细胞死亡的中心环节。该过程被认为可能是各种损伤因素导致神经元死亡的“最后公路”, 因而被称为EAA毒性损伤学说[6]。因此有学者提出“放射性脑损伤与缺血性损伤可能存在共同发病机理”的学说, 认为虽然造成大脑损伤的启动因子不同, 但继发性大脑损伤的机理却存在相似或共同的病理过程[7]。牛磺酸(taurine, Tau)是人体内含量较高的自由氨基酸, 在中枢神经系统可作为渗透压调节剂、抑制性的神经调质和神经递质[8]。研究发现, Tau对缺血、惊厥等引起的神经元损害具有对抗作用, 这种保护作用是通过对抗兴奋性氨基酸、过氧化物和调节细胞内Ca2+水平实现的。细胞外牛磺酸可能作为对抗兴奋毒性的一个重要保护机制[9]。本研究用0、10、20Gy 60Coγ射线头部照射造成脑部放射损伤模型, 在12 h后测定脑皮质Glu、Tau的含量, 结果显示, 随着照射剂量的增大, Glu的含量逐渐增加; 而Tau的含量则随着照射剂量的增大逐渐减少, Glu/Tau比值上升。用Fluo-3/AM为荧光剂, 激光共聚焦显微镜下测量细胞内游离Ca2+浓度([Ca2+]i):随着照射剂量的增大, 细胞相对荧光强度呈增加趋势。用免疫组织化学结合激光扫描共聚焦显微镜检测Glu阳性神经元, 电离辐射可使Glu阳性神经元数量增加, 细胞内相对荧光强度增强, 与照射剂量之间存在一定的剂量-效应关系。TUNEL检测结果表明, 电离辐射可导致脑皮质神经元发生细胞凋亡, 凋亡发生率与照射剂量成正比, 与文献报道一致。因此, 我们推测电离辐射诱导中枢神经系统神经元谷氨酸大量释放, 牛磺酸产生减少, Glu/Tau比值上升, 引起中枢神经组织内兴奋性神经毒性递质抑制性神经递质比例失调, 引起细胞外Ca2+内流及细胞内钙库的Ca2+动员, 导致细胞内Ca2+超载, 可能是电离辐射导致神经细胞损伤、神经功能异常的重要因素。调控中枢神经系统氨基酸类神经递质的代谢平衡, 尤其是增加牛磺酸等抑制性神经性递质的水平, 可能作为电离辐射神经系统损伤防护的途径之一[10]。
| [1] |
何声秀, 吕丽荣, 包兴才. 中毒性脑白质病[J]. 肿瘤防治杂志, 2003, 10: 105-107. DOI:10.3969/j.issn.1673-5269.2003.01.037 |
| [2] |
Ruzicka B B, Jhamandas K H. Excitatory amino acid action on the release of brain neurotransmitters and neuromodulators:biochemical studies[J]. Prog. Neurobiol., 1993, 40: 223-247. DOI:10.1016/0301-0082(93)90023-L |
| [3] |
王传松, 蔡文琴, 李才安, 等. 流式细胞计用于大鼠脑发育研究[J]. 中国神经科学杂志, 1996, 3: 125. |
| [4] |
Schulthesis TE, Kun LE, Ang KK, et al. Radiation response of the central nervous system[J]. Int J Radiat Oncol Boil Phys, 1995, 31: 1093-1112. DOI:10.1016/0360-3016(94)00655-5 |
| [5] |
Lipton SA, Rosenberg PA. Excitatory amino acids as a final common pathway for neurologic disorders[J]. N Engl J Med, 1994, 330: 613-622. DOI:10.1056/NEJM199403033300907 |
| [6] |
Belka C, Budach W, Kortmann RD, et al. Radiation induced CNS toxicity-molecular and cellular mechanisms[J]. Brit J Cancer, 2001, 85: 1233-1239. DOI:10.1054/bjoc.2001.2100 |
| [7] |
Tofilon PJ, Fike JR. The radioresponsc of the central nervous system:a dynamic process[J]. Radiat Res, 2000, 153: 357-370. DOI:10.1667/0033-7587(2000)153[0357:TROTCN]2.0.CO;2 |
| [8] |
Zhao p, Huang YL, Cheng JS. Taurine antagonizes calcium overload induced by glutamate or chemical hypoxia in cultured rat hippocampal neurons[J]. Neurosci Lett, 1999, 268(1): 25-8. DOI:10.1016/S0304-3940(99)00373-0 |
| [9] |
Saransaari P, Oja SS. Taurine and neural cell damage[J]. Amino Acids, 2000, 19(3-4): 509-526. DOI:10.1007/s007260070003 |
| [10] |
Girkin CA. Strategies for neuroprotection[J]. J Glaucoma, 2001, 10: S78-S80. DOI:10.1097/00061198-200110001-00028 |