2. 兰州大学生命科学学院
DNA损伤是放射生物学的重要研究课题, 尤其是电离辐射所致DNA单链和双链断裂是决定受照细胞结局的关键因素之一。早期建立的检测DNA损伤方法, 如染色体畸变、细胞微核等方法灵敏度较低, 操作条件不易控制, 所获得的结果仅反映群体细胞DNA损伤效应, 不能对单个细胞进行分析[1]。近年来测定DNA损伤的单细胞凝胶电泳技术(Single cell gel electrophoresis, SCGE)已在国外有关领域得到广泛的应用。
单细胞凝胶电泳技术是一种对辐射损伤进行定量测定的新技术, 在国外, SCGE技术被应用于遗传毒理学、放射生物学、环境生物监测、药物筛选、肿瘤发病机理及诊断与治疗、衰老和细胞凋亡机制的研究等[2]。该方法灵敏度高, 可检测0.045Gy下的辐射损伤[3], 并可以检测各种类型的辐射损伤[4]。本工作在建立和改进单细胞凝胶电泳技术的基础上, 研究了不同剂量γ射线对人体外周血淋巴细胞DNA的损伤效应。
1 材料和方法 1.1 试剂和药品正常熔点琼脂糖(NMA), 上海东海制药厂, 电泳用琼脂糖; 低熔点琼脂糖(LMA), D0015-2G, spanish分装; DMSO、Triton X-100、溴化乙锭(EB)由佰澳生物公司分装; 其他试剂均为分析纯。
1.2 主要设备荧光显微镜, Olympus BX60型; 电泳仪, DYY- Ⅲ型-6B型, 北京六一仪器厂; 电泳槽, DYY-Ⅲ型, 北京六一仪器厂。
1.3 生物材料正常人体外周血液。
1.4 单细胞凝胶电泳实验 1.4.1 辐照取正常人体外周静脉血6ml, 肝素抗凝, 分成6份加入表面皿中, 盖上Mylor膜。用60Co治疗机按照0.1Gy、0.5Gy、1 Gy、2Gy、3Gy和空白照射血液样品。
1.4.2 外周血淋巴细胞的分离与制片辐照后样品分别缓慢加入到有1ml淋巴细胞分离液的离心管中, 3 500 r/min, 离心20min, 吸取中间层的淋巴细胞于离心管中, 纯化后, 加PBS 0.5ml将细胞悬浮。正常熔点琼脂糖(1%)铺在磨砂载玻片, 固化后形成第一层胶。取细胞悬液在37℃下按1:3与低熔点琼脂糖(1%)充分混合, 铺到第一层胶上, 4℃固化4 min后, 即第2层胶。
1.4.3 裂解将玻片放入大培养皿中, 加入裂解液(NaCl 2.5 mol/L, EDTA-2Na 100 mol/L, 肌氨酸钠C15H28NNaO3 1%, Tris-HCl 10 mol/L pH=10, 用前加体积分数1%的Triton和体积分数10%的DMSO)裂解1 h。
1.4.4 电泳玻片放入电泳槽中, 加电泳缓冲(EDTA-2Na 1 mol/L, NaOH 300 mol/L)液漫过玻片1 cm, 静置5 min, 开始电泳, 调节电压30 V左右, 电流300 mA, 温度4℃, 避光电泳30 min。
1.4.5 染色观察将电泳后的玻片放入中和液(Tris-HCl 0.4 mol/L pH=7.5)10 min, 取出晾干。20μl EB (20 μg/ml)染色20 min。染色后的玻片置于荧光显微镜下观察, SONY CYBERSHOT数码相机同步照相, 像素1 280 ×960, 每个剂量9个平行, 每片随机观察30~40个DNA图像, 使用北京唯恩荧光分析软件进行分析。
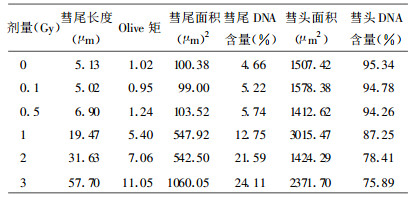
2 结果与讨论 2.1 彗星图像图 1显示了空白及不同剂量γ外照射正常人体外周血液淋巴细胞的彗星图像, 产生的原理如下:有核细胞的DNA超螺旋结构附着在核基质中, 用琼脂糖凝胶将细胞包埋在载玻片上, 用去污剂和浓盐溶解, 细胞膜、核膜及其它生物膜被破坏, 使细胞内的RNA、蛋白质及其它成分进入凝胶, 继而扩散到裂解液中, 唯独DNA所缠绕的环区(Loop)附着在剩余的核骨架上, 留在原位。细胞未受损伤时, 电泳中核DNA因其分子量大停留在核基质中, 经荧光染色后呈现圆形的荧光团, 无拖尾现象。在经受0.1-3Gy的γ射线照射后, DNA受到损伤, DNA链上存在缺口, 使DNA超螺旋变得松弛, DNA环将向外伸展, 由于缺口暴露了负电荷, 在电场的作用下, 松动的DNA环将向阳极迁移。含DNA链缺口越多, 则进入尾部的DNA越多, 表现为尾长增加和尾部荧光强度增强。因此, 通过测定DNA迁移部分的光密度或迁移长度就可定量测定单个细胞DNA损伤程度[5]。
|
图 1 不同辐照剂量下的DNA彗星图像 |
自1984年Ostling等用彗星电泳技术分析单个哺乳细胞内辐射诱发DNA损伤以来[6],SCGE技术已经用于证明各种低LET射线辐射多种细胞DNA的迁移长度与受照剂量之间的关系[7-8]。从图 1可见, 实验中彗星图像尾长适中, 分布均匀, 能够准确反映DNA的受损程度, 并且随着0-3Gy剂量的增加, 彗星图像的尾长增加, 尾部荧光强度增强。由于纯化淋巴细胞实验过程中的非生理环境, 也会对细胞产生一定的损伤, 所以在空白实验中, 彗星图像也有一定的拖尾现象。
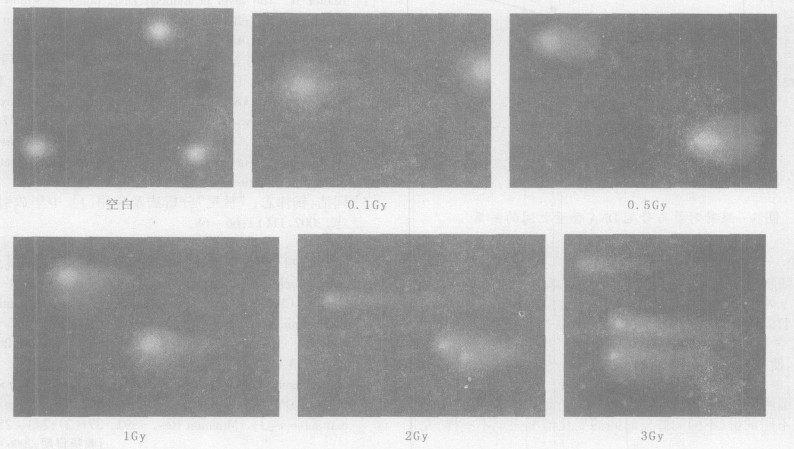
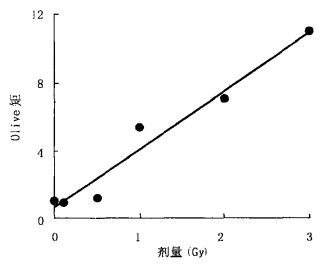
2.2 淋巴细胞DNA损伤的剂量效应关系彗星图像经荧光分析软件统计分析结果见表 1, 正常人体外周血液淋巴细胞经γ射线照射后, DNA受损而发生迁移的各个特征参数随剂量的增加而增大(彗头DNA含量随剂量的增加而减小), 呈现显著的剂量效应关系, 关系图见图 2、图 3。
|
|
表 1 γ射线照射后人体外周血液淋巴细胞DNA链断裂的各个参数变化情况 |
|
图 2 照射剂量与Olive矩之间的关系 |
|
图 3 照射剂量与彗尾DNA含量之间的关系 |
彗星荧光参数中最重要的参数是尾长、彗尾DNA含量、Olive矩。尾长与DNA损伤直接相关, 在低剂量范围内尾长与DNA损伤程度呈线性关系, 但当照射剂量超出某一范围, 尾长并不随DNA损伤程度的增加而增长, 此时, 彗尾DNA含量和Olive矩与DNA损伤程度相关性更为密切, 故在数据分析时采用了彗尾DNA含量和Olive矩这两个指标。
Olive矩是个复合指标, 即彗尾DNA含量与尾长的综合值, 能够满足多种情况下的SCGE分析。由图 2可见, Olive矩与受照剂量之间呈现良好的线性平方关系, 剂量效应的直线回归方程为:y=-0.0345x2+3.5282x+0.6542, r2=0.9609。
由图 3可知, 彗尾DNA含量与受照剂量之间呈成良好的线性平方关系, 剂量效应的直线回归方程为:y=-1.1063x2+ 10.398 x+3.5362, r2=0.9673。按照目前被延用的依据彗尾DNA含量对DNA损伤的分级评估方法, DNA损伤被分为5级: 0级(无损伤, 彗尾DNA含量 < 5%)、1级(轻度损伤, 彗尾DNA含量5%~20%)、2级(中度损伤, 彗尾DNA含量20%~40%)、3级(高度损伤, 彗尾DNA含量40%~95%)、4级(重度损伤, 彗尾DNA含量>95%)。依据这个分级评估方法, 空白实验操作中虽然对淋巴细胞造成了损伤, 彗星图像形成拖尾, 但彗尾DNA含量为4.66%, 小于5%, 仍可以认为无损伤; 0.1Gy、0.5 Gy、1 Gy辐射造成的DNA损伤为轻度损伤; 2 Gy、3 Gy剂量照射为中度损伤。彗尾DNA含量的分级评估方法虽然缺乏精确性, 但具有实用价值。
3 结论单细胞凝胶电泳技术能够准确定量地检测正常人体淋巴细胞在γ外照射条件下细胞DNA损伤的程度, 在0~3 Gy γ射线外照射的剂量范围内, 单细胞凝胶电泳的主要特征参数, 彗尾DNA含量和Olive矩, 都与受照剂量呈现良好的线性关系, 这表明, 使用单细胞凝胶电泳技术来推导生物体的受照剂量是可行的, 单细胞凝胶电泳技术有望成为新一代生物剂量计。
在细胞中, 电离辐射诱发DNA损伤是一个复杂的过程, DNA在不同剂量、不同的修复时间的变化情况完全不一样, 充分研究其作用机理和作用规律, 将对辐射防护、辐射危害评估和急性放射事故的医学处置提供有力的理论基础。
| [1] |
Radfor R. The level of induced DNA double-strand breakage correlates with cell killing after X-irradiation[J]. Int J Radiat Biot, 1985, 48: 45. |
| [2] |
张慧丽, 余卫, 闫长会. 单细胞凝胶电泳技术在军事毒理学上的应用[J]. 卫生毒理学杂志, 1999, 13(3): 182-184. DOI:10.3969/j.issn.1002-3127.1999.03.011 |
| [3] |
Fairbairn D W, Olive P L., O'neill K L. The comet assay:a comprehensive review[J]. Mutation Res, 1995, 339(1): 37-39. |
| [4] |
Cebulska W A, Nowak D, Anderson D. Correlations between DNA and cytogenetic damage induced after chemical treatment and radiation[J]. Mutation Res, 1998, 421(1): 83-91. |
| [5] |
闫洁, 杨伟志. "彗星"分析法及应用[J]. 中华放射肿瘤杂志, 2002, 11(1): 66-68. |
| [6] |
Ostling O, Johanson K J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells[J]. Biochem Biophys Res Commun, 1984, 123(1): 291-298. DOI:10.1016/0006-291X(84)90411-X |
| [7] |
He J L, Chen W L, Jin L F, et al. Comparative evaluation of the in vitro micronucleus test and the comet assay for the detection of genotoxic effects of X-ray radiation[J]. Mutat Res, 2000, 469(2): 223-231. DOI:10.1016/S1383-5718(00)00077-2 |
| [8] |
Vijayalaxmi, Tice R R, Strauss G H S. Assessment of radiation induced DNA damage in human blood lymphocytes from 100 normal subjects[J]. Mutation Res, 1992, 271(2): 243-252. |