微波辐射属非电离辐射, 不仅可干扰和破坏电子通讯设备, 亦可对生物体造成伤害, 因此微波辐射已成为一种新的环境污染而受关注。神经系统作为微波辐射最为敏感的靶部位之一尤受重视。脑赖以产生能量的底物较其他组织少, 储存的能量也很少, 但其功能复杂, 代谢十分旺盛[1]。研究表明, 微波辐射可引起机体能量代谢异常[2], 而高功率微波(high power microwave, HPM)的损伤效应报道较少。本实验旨在探讨高功率微波辐射大鼠后脑能量代谢的变化, 为阐明其损伤效应及深入探讨其机制奠定基础。
1 材料和方法 1.1 实验动物分组及辐射方法120只二级雄性Wistar大鼠, 体重(180±20) g, 由军事医学科学院实验动物中心提供, 随机分为假射组(20只)和3、10、30和100mW/cm2辐射组, 各25只。辐照方式采用脉冲微波源, 辐照时动物置于布满吸收材料的微波室内, 大鼠置于有机玻璃盒内, 照射时间为5 min。
1.2 光镜标本实验动物分别于辐射后6 h, 1, 3, 7和14d活杀取大脑皮层、海马和丘脑, 一半用10%缓冲福尔马林固定, 石蜡包埋, 甲苯胺蓝染色[3], 观察神经元胞浆中尼氏体变化; 另一半4 %多聚甲醛固定, 30%蔗糖脱水, 制作冰冻切片, 采用Wachstein-Meisel镁激活酶法行ATP酶染色, Nachlas硝基四唑蓝法行SDH染色[3]。
1.3 电镜标本取上述6h时间点大脑皮层组织和海马1mm3, 立即放入2.5%戊二醛和1%锇酸固定, 制作超薄切片, 醋酸铀和柠檬酸铅双重染色[4], 透射电镜观察大脑皮层和海马超微结构改变。
1.4 图像分析及定量方法在光镜10 ×40倍视野下, 应用CMIAS-Ⅱ图像分析仪对尼氏体、ATP酶和SDH染色结果进行积分光密度(IOD)和平均光密度(MOD)测定, 每组切片随机选取10个视野。
1.5 统计学处理文中数据用均数和标准差(x ±s)表示, 采用Origin 7.0软件t检验进行分析。
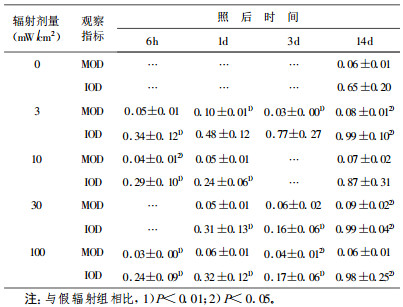
2 结果 2.1 HPM辐射后不同脑区神经元尼氏体变化 2.1.1 大脑皮层神经元尼氏体改变3 mW/cm2组仅在辐射后6 h神经元内尼氏体有所减少(P < 0.01), 1 d时已恢复正常; 10 mW/cm2和30 mW/cm2组在辐射后1 d时神经元内尼氏体明显减少(P < 0.01), 3 d时见恢复; 100 mW/cm2组在辐射后6 h时即见尼氏体明显减少(P < 0.01), 14 d时仍未恢复。表明HPM辐射后大脑皮层神经元尼氏体减少, 但恢复也较快。定量分析结果见表 1。
|
|
表 1 HPM辐照后大鼠大脑皮层神经元尼氏体含量变化 |
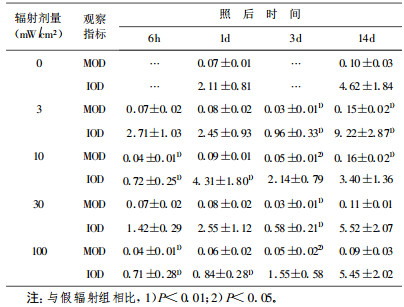
3 mW/cm2组在辐射后6 h神经元尼氏体减少(P < 0.01), 1 d时基本恢复; 10 mW/cm2组在辐射后1 d内神经元尼氏体明显减少(P < 0.01), 3 d时可见恢复; 30 mW/cm2组在辐射后3 d内神经元中尼氏体明显减少(P < 0.01); 100 mW/cm2组在辐射后6 h时见神经元尼氏体明显减少(P < 0.01), 14 d时有所恢复。表明HPM辐射后海马神经元中尼氏体明显减少。定量分析结果见表 2。
|
|
表 2 HPM辐射后大鼠海马神经元尼氏体含量变化 |
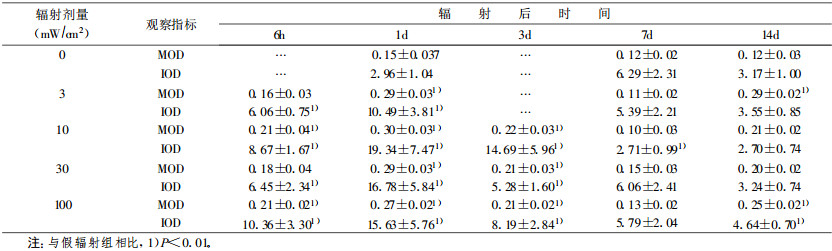
3 mW/cm2组和30 mW/cm2组在辐射后3 d时丘脑神经元尼氏体明显减少(P < 0.01); 10 mW/cm2组在辐射后6h时神经元尼氏体明显减少(P < 0.01), 1d后逐渐恢复; 100 mW/cm2组辐射后3 d内神经元尼氏体明显减少(P < 0.01), 14 d时见恢复。表明HPM辐射后丘脑神经元内尼氏体明显减少。定量分析结果见表 3。
|
|
表 3 HPM辐射后大鼠丘脑神经元尼氏体含量变化 |
3mW/cm2组在辐射后1d内ATP酶含量显著升高(P < 0.01), 3 d时基本恢复; 10 mW/cm2组在辐射后3 d内其含量显著升高(P < 0.01), 14 d时基本恢复; 30mW/cm2和100mW/cm2组在辐射后3d内其含量显著升高(P < 0.01), 7d时基本恢复, 但100mW/cm2组在辐射后14d时ATP酶含量又显著升高(P < 0.01)。表明HPM辐射后ATP酶含量显著升高。定量分析结果见表 4。
|
|
表 4 HPM辐射后大鼠大脑皮层ATP酶含量改变 |
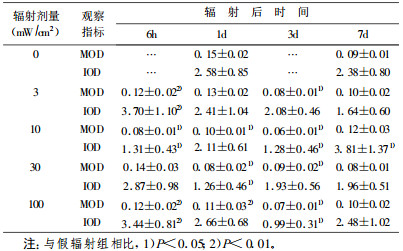
3mW/cm2组在辐射后3d内其含量降低(P < 0.01), 但有反复, 7d时基本恢复; 10mW/cm2和100mW/cm2组在辐射后3d内其含量显著降低(P < 0.01), 7d时基本恢复; 30mW/cm2组辐射后1d其含量显著降低(P < 0.01), 7d时基本恢复。表明HPM辐射后SDH含量显著降低。定量分析结果见表 5。
|
|
表 5 HPM辐射后大鼠大脑皮层SDH含量改变 |
辐射后6h, 各辐射组大脑皮层和海马均可见突触内囊泡堆积或排空, 活性区延长, 突触间隙模糊不清, 突触后致密物增加及突触穿孔; 髓鞘局灶融合、解离; 血管周间隙增宽。且海马神经元见胞浆疏松, 线粒体肿胀, 嵴断裂, 甚至空化, 粗面内质网扩张, 脱颗粒, 核膜间隙增宽, 染色质浓缩、边集; 胶质细胞水肿; 而大脑皮层神经元及胶质细胞改变轻微。可见海马损伤重于皮层, 且各辐射组间损伤无明显差异。
3 讨论脑赖以产生能量的底物较其他组织少, 储存的能量也较少, 但其功能复杂, 代谢十分旺盛。尼氏体特异性分布于神经元胞体和树突, 其在电镜下是由粗面内质网、游离核糖体和多核糖体构成, 是神经元合成蛋白质最活跃的部位, 尼氏体减少或消失是神经元损伤的表现[5]。线粒体是细胞有氧氧化合成ATP的部位, 同时也是对一般损伤最敏感的细胞器。线粒体的损伤将影响到神经元的能量代谢, 从而影响到神经元的形态和功能。ATP酶和琥珀酸脱氢酶(SDH)与细胞能量的产生和利用密切相关。神经元内ATP酶是维持神经元兴奋传导、突触传递和离子内环境稳定的物质基础, 观察ATP酶含量变化有助于揭示神经元损伤机制。脑所需的能量主要靠糖代谢供给, 糖的有氧代谢过程中琥珀酸需在SDH的参与下分解, 分析脑组织中SDH的含量可反应机体内物质氧化、功能代谢状态及线粒体功能。
研究表明, 微波辐射可引起脑能量代谢异常。Albert EN[6]采用2 450MHz、10mW/cm2微波辐照幼鼠后1d, 光镜发现小脑浦肯野细胞尼氏体完全崩解。电镜下, 浦肯野细胞粗面内质网排列紊乱。另有学者发现HPM辐射大鼠后, 可使海马和下丘脑神经元尼氏体减少, 甚至消失[7, 8]; 但也有学者发现, 20mW/cm2组微波辐照小鼠后, 大脑皮层神经元尼氏体有部分扩大现象[9]。赵亚丽等用2450MHz微波辐射小鼠, 发现1mW/cm2组大脑皮层、海马和丘脑Ca2+、Mg2+ -ATP酶活性均增高, 5mW/cm2组均无改变, 但10mW/cm2组皮层、海马Ca2+、Mg2+ -ATP酶活性下降, 海马神经元电压依赖性Na+, K+, Ca2+离子通道被影响, 而丘脑无改变[10, 11], 表明微波辐射影响了海马和皮层功能(如学习记忆功能)。也有学者采用3GHz, 8mW/cm2脉冲微波辐照胎鼠和5mW/cm2辐照小鼠后, 发现下丘脑和海马的SDH均显著下降[12, 13]
鉴于HPM辐射对脑代谢的影响报道较少。本研究采用甲苯胺蓝染色方法检测3 ~ 100mW/cm2 HPM辐射对大脑皮层、海马和丘脑神经元尼氏体的影响, 发现HPM可引起尼氏体减少甚至消失, 但偶可见尼氏体增加, 可能与机体的适应性反应有关。采用组织化学染色的方法检测3 ~ 100mW/cm2 HPM辐射后ATP酶和SDH的含量改变。结果发现, 辐射后3d内, 3mW/cm2、10mW/cm2、30mW/cm2和100mW/cm2组ATP酶含量均明显升高, SDH含量均明显降低。表明脑能量代谢障碍, 由于脑内ATP储备较少, 微波辐射后细胞启动自身调节机制, 能量产生随之增加, 7d时基本恢复正常, 表明机体损伤尚在代偿能力之内。电镜下可见HPM辐射后6h线粒体肿胀, 嵴断裂, 甚至空化; 光镜下神经元的水肿、变性可能和HPM对线粒体和粗面内质网的损伤有关。
综上, 3 ~ 100mW/cm2 HPM辐射后ATP酶含量升高, SDH含量降低, 表明HPM辐射后脑糖代谢障碍, ATP酶反应性的升高来对抗这种改变, 直至7d二者基本恢复, 且二者动态变化规律基本一致。此外, 脑细胞能量代谢异常与脑细胞的损伤密切相关, 能量代谢恢复后, 脑损伤也逐渐恢复。HPM辐射后大脑皮层和海马线粒体明显损伤, 是脑代谢障碍的结构基础。HPM辐射后大脑皮层和海马尼氏体减少, 在超微结构可见粗面内质网的损伤, 表明粗面内质网损伤后, 蛋白合成异常, 加重细胞损伤; 反过来细胞损伤持续进展, 又可导致内质网的进一步损伤。
| [1] |
Pakhomov AG, Doyle J, Stuck BE, et al. Effects of high power microwave pulses on synaptic transmission and long term potentiation in hippocampus[J]. Bioelectromagnetic, 2003, 24(3): 174-181. DOI:10.1002/bem.10079 |
| [2] |
Beason RC, Semm P. Response of neurons to an amplitude modulated microwave stimulus[J]. Neurosci Lett, 2002, 333(3): 175-178. DOI:10.1016/S0304-3940(02)00903-5 |
| [3] |
龚志锦, 詹洲. 病理组织制片和染色技术[M]. 上海: 上海科学技术出版社, 1994.
|
| [4] |
王伯云, 李玉松, 黄高升, 等. 病理学技术[M]. 北京: 人民卫生出版社, 2000: 283-294.
|
| [5] |
蔡文琴, 阮怀珍, 黎海蒂. 医用神经生物学基础[M]. 重庆: 西南师范大学出版社, 2001.
|
| [6] |
Albert EN, Sherif M. Morphological changes in cerebellum of neonatal rats exposed to 2. 45 GHz microwaves[J]. Prog Clin Biol Res, 1988, 257: 135-151. |
| [7] |
杨瑞, 彭瑞云, 高亚兵, 等. 高功率微波辐射对大鼠海马损伤效应的研究[J]. 中华劳动卫生与职业病杂志, 2004, 22(3): 211-214. |
| [8] |
孟丽, 彭瑞云, 高亚兵, 等. S波段高功率微波对大鼠下丘脑垂体肾上腺轴的功能及形态影响[J]. 军事医学科学院院刊, 2005, 29(1): 25-29. DOI:10.3969/j.issn.1674-9960.2005.01.007 |
| [9] |
陶松贞, 郭友池, 李学荣, 等. 雄性小白鼠大脑皮质细胞超微结构的影响[J]. 第四军医大学学报, 1982, 3(4): 278-280. |
| [10] |
赵亚丽, 宋锦萍, 杨玉华, 等. 不同强度微波辐射对小鼠脑组织钙、镁ATP酶活性的影响[J]. 中华航天航空医学杂志, 2000, 11(2): 101-104. |
| [11] |
Zhao YL, Ma HB, Song JP, et al. Effects of microwave irradiation on ATPase activity and voltage dependent ion channel of rat hippocampus cell membrane[J]. Space Med Med Eng (Beijing), 2003, 16(1): 36-40. |
| [12] |
姜槐, 姚耿东, 周水云. 微波辐射对胎鼠及新生子鼠下丘脑和肝SDH相对活性的影响[J]. 辐射防护, 1987, 7(3): 229-232. |
| [13] |
蒲京遂, 陈建. 3000MHz微波辐射对鼠脑电能量和脑组织酶的影响[J]. 航天医学与医学工程, 1995, 8(4): 262-264. |



 ,
,