化疗是治疗肿瘤的重要手段, 但化疗杀死肿瘤细胞的同时, 化疗药物也使正常组织受到损伤, 导致正常机能被抑制或破坏, 抗病能力下降, 特别是免疫力降低又给肿瘤的治疗造成不利影响。文献报道低剂量辐射具有免疫兴奋性效应[1]和适用性反应[2], 因此能否把低剂量辐射的生物学兴奋效应和适用性反应应用到肿瘤化疗中, 减轻其对正常组织的损伤, 尤其是免疫系统和遗传物质的损伤, 保护机体的正常机能而且达到治疗的目的。笔者用中性单细胞凝胶电泳(又称彗星试验, SCGE)的方法研究低剂量辐射对荷瘤鼠化疗后外周血淋巴细胞DNA损伤的影响, 探讨低剂量辐射对荷瘤鼠机体正常组织保护作用的机制。
1 材料和方法 1.1 动物模型的制备① 实验动物:由中国医学科学院放射医学研究所提供的IRM -2纯近交系小鼠, 体重(23±2) g, 雌雄各半, 检疫1周后分组接种淋巴瘤细胞。②淋巴瘤细胞种植:在无菌条件下取荷瘤鼠淋巴瘤新鲜瘤组织, 加等体积生理盐水匀浆后成瘤细胞悬液, 取0.5 ml(约106个细胞)于小鼠右侧小腿外侧皮下注射。
1.2 照射条件和化疗条件用137Csγ射线5cGy低剂量全身照射, 剂量率0.054 Gy/min, 照射后6 h腹腔注射环磷酰胺(江苏恒瑞医药股份有限公司, 生产批号: 05010821), 40 mg/kg, 低剂量照射和化疗都连续3 d给予。
1.3 动物分组当荷瘤鼠肿瘤结节达0.4~ 0.5 cm大小时, 随机分成3组, 每组8只小鼠: ①对照组, 不作任何处理的荷瘤鼠组; ②单独环磷酰胺, 腹腔注射, 1次/d, 40 mg/kg, 连续3 d。③低剂量辐射联合环磷酰胺组, 化疗前6 h接受5cGy低剂量辐射, 连续三天。
1.4 实验方法中性单细胞凝胶电泳参照张军宁[3]的方法并稍加修改:取各组荷瘤鼠外周血0.2 ml, 肝素抗凝, 加入到等体积淋巴细胞分离液上, 3 500 r/min离心4 min, 取中间层淋巴细胞并加入PBS至2 ml, 1 500 r/min离心8 min, 重复洗涤细胞两次。①琼脂糖玻片的制备:使用两层凝胶法, 第一层为100 μl 0.75%正常熔点琼脂糖凝胶, 第二层为75 μl 0.75 %低熔点琼脂糖凝胶和25 μl淋巴细胞的混合液。②细胞裂解:将制好的玻片浸入新配制的中性裂解液(2mol LNaCl, 30 mmol/L EDTA, 1%SLS, 10 mmol/L Tris, 用前加1 %TritonX -100和10 %DMSO, pH 8.2 ~ 8.5)中裂解1.5 h。③电泳:取出玻片, 用0.5%电泳液(2 mmol/L EDTA, 90 mmol/L Tris, 90 mmol/L硼酸, pH 8.2 ~ 8.5)浸没漂洗多余的盐液, 并松解20 min; 然后置于0.5%电泳液中电泳25 min, 电压20 V。④读片和分析: 100 μl溴化乙啶(20 μg/ml)染色后用荧光显微镜(激发波长515~ 560 nm)观察玻片, 每只动物随机抓取40个慧星(一组8只动物, 共320个细胞)图像并用数码相机拍照后输入计算机储存, 用CASP软件分析系统分析慧星图像。
1.5 统计分析用SPSS11.0作统计处理, 组间比较用秩和检验。
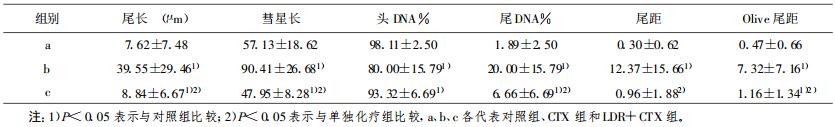
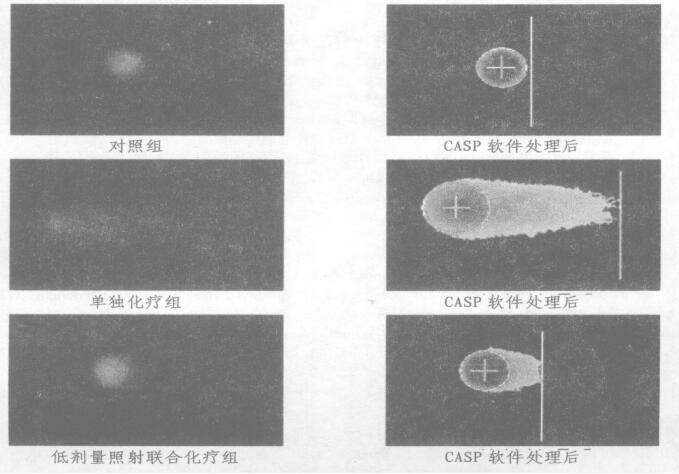
2 结果 2.1 中性单细胞凝胶电泳统计结果实验结果显示单独环磷酰胺组尾长、彗星长、头DNA%、尾DNA%、尾矩、Olive尾矩其均数远远大于对照组, 与对照组比较差异具有显著性(P < 0.05), 说明环磷酰胺对外周血淋巴细胞的损害很大; 低剂量照射联合环磷酰胺组虽然与对照组比较也具有统计学差异(P < 0.05), 但是其尾长、彗星长、头DNA%、尾DNA%、尾矩、Olive尾矩等均数小于单独化疗组, 差异具有显著性(P < 0.05), 说明说明低剂量全身照射可以保护外周血淋巴细胞的损伤。各实验组彗星图像及其分析图像如图 1所示。
|
|
表 1 中性单细胞电泳实验结果(x ±s) |
|
图 1 各实验组慧星图像分析图像 |
用单细胞凝胶电泳检测低剂量辐射与化疗结合的研究报道很少, 国内未查到相关报道, 国外有Dobrzynska[4]报道过。SCGE技术是一种快速、灵敏的DNA检测技术。目前在SCGE图像分析领域, 除了昂贵的商业软件外, 也出现了一些免费的彗星分析软件。如Helma等[5]所设计的软件(Sicion Image)能测量彗星强度、尾长、头面积、尾面积、尾部DNA含量、尾矩等多项参数, 而且该软件可根据需要进行修改, 并具有操作简便、快捷的优点。Koncak等[6]在Helma的基础上研制了另一软件(CASP), 该软件可在多种硬件及软件平台上运行, 所测量的彗星参数中增加了Olive尾矩, 而且用户界面更友好, 该分析软件对头DNA%、尾DNA %、尾距、Olive尾距等指标进行更为直观、准确、省时省力的分析。笔者用中性单细胞凝胶电泳检测了低剂量辐射与化疗结合对外周血淋巴细胞的DNA损害。
1984年Olivieri[7]等人报道低剂量3H -TdR作用于人外周血淋巴细胞可诱导其对随后较大剂量X射线的抗性, 并首次提出了低剂量辐射诱导细胞遗传学适应性反应。适用性反应表现为细胞对随后作用的大剂量辐射所导致的遗传损伤效应减弱, 包括染色体损伤的减少、基因突变率和细胞死亡的下降, 电离辐射以外的其他手段, 例如辐射类似物、碱基修饰物或交联剂的作用等也能引发适用性反应, Zhou等[8]报道用3Gyγ线攻击小鼠乳癌细胞SR-1前18h或24h, 或接受抗肿瘤药物博莱霉素(主要造成细胞DNA链断裂)攻击前12h预先接受1cGy的低剂量照射, 发现和对照组比较诱导的hprt基因突变显著减少, 显示出交叉适应性反应。Wolff等[9]报道人淋巴细胞接受0.01Gy的X射线或低剂量氚化胸苷, 随后用大剂量的博来霉素(诱导DNA双链损害)、丝裂霉素C(诱导DNA交联)进行攻击, 博莱霉素和丝裂霉素C攻击后产生的染色单体和异染色单体断裂的数目明显减少, 大约是预期的一半, 这表明预先的0.01GyX射线的照射不但可减少双链断裂引起的染色单体损害, 也可减少DNA交联剂引起的染色单体损害。环磷酰胺是一种抗肿瘤的烷化剂, 具有活泼的烷化基团, 与DNA的两条互补链上各一个核酸碱基产生共价结合, 形成交叉联结, 导致DNA链的断裂, 直接抑制DNA的复制。环磷酰胺在治疗肿瘤的同时还能引起较多的副作用, 对正常组织具有损伤作用。低剂量辐射与环磷酰胺联合治疗肿瘤可利用低剂量辐射的适用性反应, 减轻环磷酰胺对正常组织的损伤作用。
低剂量辐射出现适用性反应与剂量、剂量率和时间有关, Shadley[10]等发现低剂量辐射诱导的适用性反应在给50cGy以1cGy/min的剂量率给予时能出现, 但是以10cGy/min或更高剂量率的时候没有出现, 反而给1cGy的剂量以剂量率20cGy/min可以出现适用性反应, 但是以0.5cGy/min的剂量率给予时未出现适用性反应。Ikushima T报道[11]单次照射培养的哺乳动物细胞所诱发的适用性反应只有一个很窄的剂量范围, 最佳的计量范围为0.1 ~ 10cGy。Sasaki MS等[12]也报道低剂量辐射诱导的适用性反应的剂量范围不大于10cGy。低剂量辐射诱导的适用性反应也与低剂量照射给予的时间有关, Shadley JD等[13]报道低剂量照射在攻击照射前1 ~ 6 h给予, 发现4h以后能诱导出适用性反应, 低于这个时间不能诱导出适用性反应。本实验中低剂量辐射给予后6 h后注入环磷酰胺(40 mg/kg), 剂量是5 cGy/d, 与文献建议的低剂量辐射给予的剂量和时间相符和, 实验结果显示单纯化疗组引起明显的外周血DNA损伤, 但是与低剂量辐射联合给予后这种损伤减少, 说明5 cGy低剂量辐射以0.054Gy/min给予时可诱导适用性反应的出现。
在本实验中笔者用中性单细胞凝胶电泳检测到了低剂量辐射联合化疗组外周血淋巴细胞DNA的损害明显小于单独化疗组, 再一次证实低剂量辐射对荷瘤鼠的正常机体具有保护作用, 为低剂量辐射应用于临床, 减轻化疗损伤、保护机体正常组织的机制方面提供了理论依据。
| [1] |
Liu XD, Ma SM, Liu SZ. Effects of 0. 075 Gy X-ray irradiation on the expression of IL-10 and IL-12 in mice[J]. Phys Med Biol, 2003, 48(13): 2041-2049. DOI:10.1088/0031-9155/48/13/315 |
| [2] |
Wang GJ, Cai L. Induction of cell-proliferation hormesis and cell - survival adaptive response in mouse hematopoietic cells by whole -body low -dose radiation[J]. Toxicological Sciences, 2000, 53(2): 369-376. DOI:10.1093/toxsci/53.2.369 |
| [3] |
张军宁, 洪承皎, 朱寿彭. 单细胞凝胶电泳检测外照射诱导DNA单链断裂和双链断裂[J]. 辐射研究与辐射工艺学报, 2002, 3: 220-223. DOI:10.3969/j.issn.1000-3436.2002.03.013 |
| [4] |
Dobrzy′nska MM. The effects in mice of combined treatments to X -rays and antineoplastic drugs in the comet assay[J]. Toxicology, 2005, 27: 331-338. |
| [5] |
Konca K, Lankoff A, Banasik Anna, et al. A cross2platform public domain PC image2analysis program for the comet assay[J]. Mutat Res, 2003, 534(1-2): 15-20. DOI:10.1016/S1383-5718(02)00251-6 |
| [6] |
Helma C, Uhl M. A public domain image analysis programfor the single cell electrophoresis (comet) assay[J]. Mutat Res, 2000, 466(1): 9-15. DOI:10.1016/S1383-5718(99)00232-6 |
| [7] |
Olivieri G, Bodycote J, Wolff S. Adaptive response of human lym phocytes to low concentrations of radioactive thymidine[J]. Science, 1984, 223: 594-597. DOI:10.1126/science.6695170 |
| [8] |
Zhou PK, Liu XY, Sun WZ, et al. Cultured mouse SR-1 cells exposed to low dose of gamma -rays become less susceptible to the induction of mutagenesis by radiation as well as bleomycin[J]. Mutagenesis, 1993, 8(2): 109-111. DOI:10.1093/mutage/8.2.109 |
| [9] |
Wolff S, Afzal V, Wiencke JK, et al. Human lymphocytes exposed to low doses of ionizing radiation become refractory to high doses of radiation as well as to chemical mutagens that induce double - strand breaks in DNA[J]. Int J Radiat Biol, 1998, 53(1): 39-48. |
| [10] |
Shadley J, Wiencke JK. Induction of the adaptive response by X -rays is dependent on radiation intensity[J]. Int J Radiat Biol, 1989, 56: 107-118. DOI:10.1080/09553008914551231 |
| [11] |
Ikushima T. Radioadaptive response: characterization of a cytogenetic repair induced by low -level ionizing radiation in cultured Chinese hamster cells[J]. Mutat Res, 1989, 227: 241-246. DOI:10.1016/0165-7992(89)90104-8 |
| [12] |
Sasaki MS. On the reaction kinetics of the radioadaptive response in cultured mouse cells[J]. Int J Radiat Biol, 1995, 68(3): 281-29. DOI:10.1080/09553009514551211 |
| [13] |
Shadley JD, Afzal V, Wolff S. Characterization of the adaptive response to ionizing radiation induced by low doses of X rays to human lymphocytes[J]. Radiat Res, 1987, 111(3): 511-517. |