急性辐射后生物剂量的估算有着不可替代的优越性。国内外研究人员为解决核辐射事故医学应急的生物剂量估算工作中倾注了大量心血。准确估算受照者的吸收剂量, 对于放射损伤的诊断、医疗监督和事故处理等至关重要。这就需要一个较为准确可靠的生物剂量计。用SCGE方法观察照后淋巴细胞DNA损伤情况, 进一步拟合剂量-效应曲线, 需要用离体人血进行实验, 但是, 离体血照射是否能够真实准确地反映整体照射的损伤情况呢?这就需要动物实验来证实。为此, 本部分工作在建立和改良SCGE技术的基础上, 研究了γ射线对小鼠外周血淋巴细胞离体和整体照射后DNA损伤的一致性研究。
1 材料和方法 1.1 主要试剂和仪器正常熔点琼脂糖凝胶购自Biowest公司, 低熔点琼脂糖凝胶为Promega公司产品, Tris-HCl、DMSO和TritonX-100均为Sigma公司产品, 中国医学科学院血液学研究所科技公司分装。水平电泳仪为BIO-RAD公司产品, 日本产Nikon荧光显微镜和数码相机, 137Cs γ辐射源购自加拿大原子能有限公司。
1.2 实验动物及准备本所动物室培育的经过鉴定的IRM-2近交系小鼠, 6~7周龄, 体重(20±2)g。取该种小鼠6只, 雌雄各半, 随机分成两个剂量组, 分别为1 Gy照射组和2 Gy照射组。
采小鼠外周血约0.2ml, 肝素抗凝。所取外周血与小鼠对应编号后, 在相同条件下同时照射, 照后立即再次以相同方法取小鼠外周血约0.2ml, 肝素抗凝, 备用。
1.3 照射条件137Cs γ射线全身均匀照射, 吸收剂量率:0.8451 Gy/ min, 照射剂量分别为1 Gy和2 Gy。
1.4 淋巴细胞分离预先在0.5 ml离心管中加入4℃预冷的0.2 ml淋巴细胞分离液, 所取外周血沿离心管内壁轻轻加在淋巴细胞分离液面上, 3 500 rpm离心2 min, 离心管内可见一层灰白色淋巴细胞层, 转移至2 ml离心管中, 加PBS至2 ml, 轻摇混匀后1 500 rpm离心6 min, 弃上清。如此重复洗涤细胞2次, 再将细胞悬于PBS, 调整细胞浓度至2×104 ml, 置4℃冰箱, 备用。
1.5 中性单细胞凝胶电泳实验参考Banath等[1]的方法, 并稍加改良。
1.5.1 铺胶0.75%正常熔点琼脂糖凝胶煮沸后取100 μl迅速均匀铺于自制微电泳槽内, 置于4℃冰箱1 min使凝胶固化, 取制好的淋巴细胞悬液25 μl与75 μl 0.75%低熔点琼脂糖凝胶混匀后均匀铺于第一层凝胶上面, 置于4℃冰箱固化1 min。
1.5.2 裂解将微电泳槽置于新鲜配制的中性裂解液中, 4℃冰箱中裂解1.5h;
1.5.3 电泳裂解后取出微电泳槽, 用双蒸水漂洗去掉多余的盐分, 置于提前加入4℃0.5%TBE电泳液的水平电泳仪中静置20 min, 然后在20V, 200 mA电泳条件下电泳20 min。
1.5.4 染色和观察2 μg/ml溴化乙锭(EB)染色, 双蒸水漂洗, 去掉多余染液, 先在荧光显微镜低倍镜下观察彗星, 然后在高倍镜下, 用Nikon数码相机随机抓取彗星图像, 每份样品拍摄200个彗星图像, 每组累计600个细胞。
1.6 彗星图像的分析每个彗星图像均采用波兰某大学提供的CASP[2]系统自动分析, 分析结果输出保存为文本文件(.txt), 可以用SPSS12.0统计软件直接读取。
1.7 统计学分析取彗星尾长、彗星全长、头部DNA %、尾部DNA%、尾矩和Olive尾矩作为分析指标。采用SPSS12.0统计软件对上述指标进行t检验, 相关分析采用SPSS软件的Bivariate相关分析, 计算Pearson相关系数。
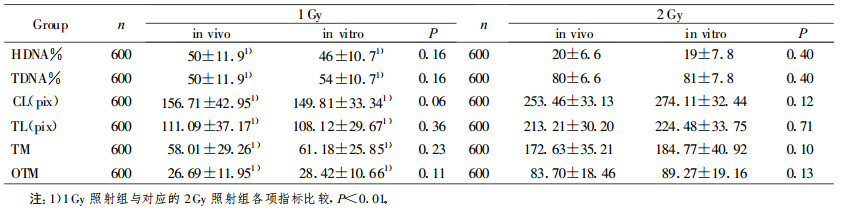
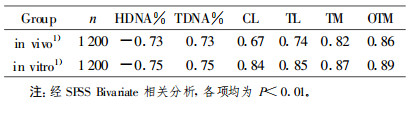
2 结果 2.1 中性单细胞凝胶电泳图像小鼠外周血离体照射和整体照射后致细胞DNA双链断裂, 经中性裂解液去除核膜和蛋白质, 当细胞核DNA在电泳液中充分解旋后, 在电场的作用下, DNA断片离开细胞核, 向阳极迁移, 形成彗星状拖尾。1 Gy和2 Gy照射组彗星图像分别见图 1和图 2。
|
图 1 1 Gy137Cs γ射线照后彗星图像 A:离体照射的彗星图像B:整体照射的彗星图像A1:A经CASP软件分析的图像B1:B经CASP软件分析的图像 |
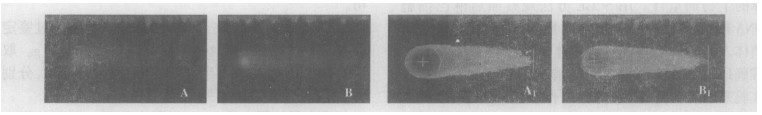
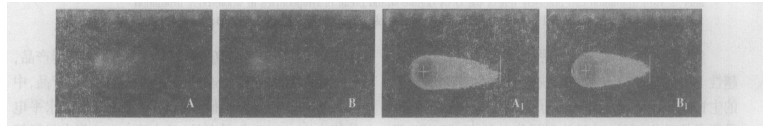
|
图 2 2 Gy137Cs γ射线照后彗星图像 A:离体照射的彗星图像B:整体照射的彗星图像A1:A经CASP软件分析的图像B1:B经CASP软件分析的图像 |
由图 1和图 2均可见, 离体和整体照射后的淋巴细胞均出现明显拖尾现象, 彗星图像经CASP软件分析后, 得到头尾清晰可辨的新图像, 更加直观地显示出彗星的头部和尾部, 反映细胞核DNA在彗星中的分布情况, 同时给出各项量化指标。肉眼观察2 Gy照射组的彗星尾长明显大于1 Gy照射组的彗星尾长。
2.2 137Cs γ射线离体、整体外照射致淋巴细胞DNA双链断裂表 1列出小鼠淋巴细胞分别经137Cs γ射线1 Gy和2 Gy离体和整体照射后诱导DNA双链断裂, DNA断片发生迁移的彗星头部DNA%、尾部DNA%、彗星全长、彗星尾长、尾距和Olive尾距。
|
|
表 1 1 Gy、2 Gy离体和整体照射小鼠后DNA迁移的各项指标(x±s) |
在1 Gy和2 Gy两个剂量组内部的离体与整体照射比较, P>0.05。
由表 1可见, 无论1 Gy照射组与2 Gy照射组, 其离体和整体照射的各项指标经统计学分析, 差异均未见显著性(P>0.05)。同时, 将1 Gy照射组与2 Gy照射组的数据进行对比, 2 Gy照射的各项指标均高于1 Gy照射的指标, 相应项进行比较, 差异均具有非常显著性(P<0.01)。随照射剂量的增加, TDNA%在总的彗星DNA中明显升高, 同时, DNA片段的迁移长度也明显增加。
表 2列出1 Gy照射组与2 Gy照射组之间各项指标的相关系数。由表 2可见, 两组间的HDNA%为负相关, 其余指标为正相关, 且均为P<0.01。以TM和OTM的相关性最强。
|
|
表 2 1 Gy照射组与2 Gy照射组之间各指标的相关系数(R) |
目前应用比较广泛的辐射生物剂量学方法包括染色体畸变法、微核测定法等, 用染色体畸变或微核实验作为生物剂量计, 首先要明确离体照射和整体照射导致畸变率的一致性, 然后在离体条件下, 对健康人外周血样品照射不同剂量, 建立染色体畸变率(或微核率)和剂量之间关系的刻度曲线。目前, 我国已经建立了多种射线照射离体人血的剂量-效应关系刻度曲线, 并在辐射事故的剂量估计中得到应用。但是, 上述方法需要淋巴细胞培养, 至少需要2~3d的时间才能给出结果。越来越多的研究资料表明[2~5], 用单细胞凝胶电泳技术检测照后淋巴细胞DNA链断裂, 得到的尾长等指标具有较好的剂量-效应关系, 为该技术作为辐射生物剂量计打下了良好基础。
SCGE是上世纪八十年代建立的用于检测DNA断裂的新技术[6, 7], 并由Olive[8]等建立了用于测定DNA双链断裂的中性SCGE, 在各个相关领域得到广泛应用。国内该技术的发展稍滞后于国外的进展。近几年来, 该技术在国内生物学、毒理学、肿瘤学、环境医学等领域才得到广泛应用, 而且目前国内外均未见报道以该方法用于辐射生物剂量计。该方法简便、迅速、灵敏, 与其它DNA断裂检测技术相比, 具有明显优势:①从单细胞水平上检测DNA原发损伤, 避免了只能对细胞群体的DNA改变进行检测的不足; ②适用范围广:可检测多种类型的组织细胞, 而且对T和B淋巴细胞均敏感; ③简便、经济、快速:所需样品数目少(只需0.2ml全血), 无需放射性核素, 检测时间短, 步骤简单, 花费甚少; ④敏感性高:可检测到0.05 Gy的低水平辐射, 比传统生物剂量学技术具有更高的敏感性。
大量的实验资料已表明:辐射诱发的人体外周血淋巴细胞的DNA损伤与吸收剂量之间有着密切的关系。辐射生物剂量学指标需要具备的前提就是需经实验证明体内与体外一致, 为了对整体受照所诱发的DNA损伤进行生物剂量估算, 就必须首先研究离体条件下的辐射效应。本研究旨在检验全身照射和离体照射致DNA双链断裂的一致性, 以明确SCGE技术作为辐射生物剂量计的可行性。结果显示, 1 Gy和2 Gy两个剂量组的全身照射和离体照射所得彗星头部DNA %、尾部DNA%、彗星全长、彗星尾长、尾矩和Olive尾矩等指标均有一致性, 说明该技术离体实验可以客观准确地反映整体照射的淋巴细胞DNA损伤, 进一步证明SCGE技术在辐射生物剂量学中的应用价值。从1 Gy照射组和2 Gy照射组之间的横向比较来看, 随照射剂量加大, 各项指标的数值均明显升高, 呈显著相关。可以初步判断SCGE技术可以用于辐射生物剂量计的研究。SCGE作为一项新的DNA断裂测定技术, 尚处在发展和完善阶段, 相信, 随着该技术的不断优化, 其在辐射生物剂量学中的应用将开拓出一片广阔的天空。
| [1] |
Banath JP, Fushiki M, Olive PL. Rejoining of DNA single and double-strand breads in human white blood cells exposed to ionizing radiation[J]. Int J Radiat Biol, 1998, 73(6): 649-660. DOI:10.1080/095530098141906 |
| [2] |
Konca K, Lankoff A, Banasik A, et al. Across-platform public domain PC image-analysis program for the comet assay[J]. Mutat Res., 2003, 534(1~2): 15-20. |
| [3] |
Chaubey RC, Bhilwade HN, Rajagopalan R, et al. Gamma ray induced DNA damage in human and mouse leucocytes measured by SCGE-Pro:a software developed for automated image analysis and data processing for Cometassay[J]. Mutat Res, 2001, 490(2): 187-197. DOI:10.1016/S1383-5718(00)00166-2 |
| [4] |
He JL, Chen WL, Jin LF, et al. Comparative evaluation of the in vitro micronucleus test and the comet assay for the detection of genotoxic effects of X-ray radiation[J]. Mutat Res, 2000, 469(2): 223-231. DOI:10.1016/S1383-5718(00)00077-2 |
| [5] |
Hellman B, Vaghef H, Bostrom B. The concepts of tail moment and tail inertia in the single cell gel electrophoresis assay[J]. Mutat Res, 1995, 336(2): 123-131. DOI:10.1016/0921-8777(94)00047-A |
| [6] |
Ostling O, Johanson KJ. Microelectrophoretic study ofr adiationinduced DNA damages in individual mammalian cells[J]. Biochem Biophys Res Commun, 1984, 123(1): 291-298. DOI:10.1016/0006-291X(84)90411-X |
| [7] |
Ejchart A, Sadlej-Sosnowska N. Statistical evaluation and comparison of comet assay results[J]. Mutat Res, 2003, 534(1~2): 85-92. |
| [8] |
Olive PL, Wlodek D, Banath JP. DNA double-strand breaks measured in individual cells subjected to gel electrophoresis[J]. Cancer Res, 1991, 51(17): 4 671-4 677. |



 ,
,