2. 中国医学科学院放射医学研究所;
3. 北京市疾病预防控制中心
重组人粒细胞集落刺激因子是与人类的G-CSF生物学活性完全相同的大分子蛋白质, 选择性作用于造血祖细胞, 促进其增殖、分化, 并可增加粒系终末分化细胞功能。临床主要用于癌症化疗等原因导致的中性粒细胞减少症、促进骨髓移植后中性粒细胞升高、骨髓发育不良引起的中性粒细胞减少症等。研究发现许多肿瘤细胞能合成G-CSF, 并且G-CSF能促进某些肿瘤细胞的生长和转移。在辐射诱发肿瘤过程中, 特别是在促癌阶段, 多种因素都能起促进作用, 但G-CSF对辐射致细胞恶性转化过程是否有影响尚未见报道。
1 材料和方法 1.1 试剂和仪器G-CSF购自北京邦定生物医学公司。RPMI-1640培养基、MTT为Gibco公司产品。BIORAD Model 550酶联免疫检测仪, 为日本BIO-RAD公司产品。FACS-Calibur流式细胞仪, 为美国B-D公司产品。
1.2 细胞转化Wistar大鼠肺细胞为本实验室冻存, 培养于含15%胎牛血清的RPMI-1640培养基中。实验分为4组。对照组:正常Wistar大鼠肺成纤维细胞; 单纯4Gy组:60Coγ射线单次照射, 剂量为4 Gy/(剂量率为1.819 Gy/min); G-CSF预处理组:细胞先用100 ng/ml G-CSF处理3 d, 再经60Co γ射线4 Gy照射, 照后洗去药物; 4 Gy+GCSF组:细胞用60Co γ射线4 Gy照射后, 再加G-CSF100 ng/ml持续处理。所有组行上述处理后, 进行细胞常规传代。
1.3 细胞增殖活力的MTT比色法检测将细胞以5 ×103 ml的密度接种于96孔板中, 200 μl孔, 每组设5个平行孔, 分别用GCSF12.5、50、100、200 ng/ml处理3 d后, 加入20 μl MTT, 于37℃继续孵育4 h。弃去培养液及MTT, 加入二甲基亚砜200μl, 混匀后, 用酶联免疫仪测定波长570 nm的吸光度值。
1.4 软琼脂克隆形成率(CFE)试验在35 mm培养皿中铺上底层琼脂(0.5%琼脂), 凝固后加入1 ml上层琼脂(0.3%琼脂, 内含1 ×103的细胞), 每组5皿。37℃, 0.5% CO2恒温培养20 d观察结果, 计数集落形成率。
1.5 流式细胞仪检测细胞周期细胞达到指数生长期时, 用0.25%胰酶消化细胞, 1000 r/min离心5 min, PBS洗涤两次, 再用预冷70%乙醇固定过夜。上机前用PBS洗涤两次, 加入200 μl (lg/l) RnaseA酶, 37℃水浴30 min, 加入300 μl 100 mg/l的碘化丙啶(PI), 放置暗处染色20 min, 用流式细胞仪检测。
1.6 应用SPSS11.0 for/windows进行统计学分析计量资料以均数±标准差表示, 采用单因素方差分析。
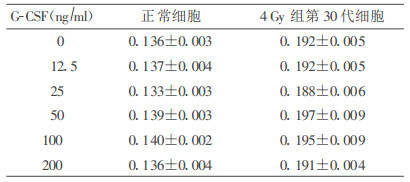
2 结果 2.1 G-CSF对正常Wistar大鼠肺成纤维细胞和60Co γ射线4 Gy照射后第30代细胞生长的影响(表 1)|
|
表 1 G-CSF对正常Wistar大鼠肺成纤维细胞和单纯60Co γ射线照射后第30代细胞生长的影响 |
由表 1可见, 不同浓度的GCSF对正常细胞和单纯4 Gy照射组第30代细胞的增殖影响不大, 各剂量组与对照组比, 差异均无显著性(P>0.05)。
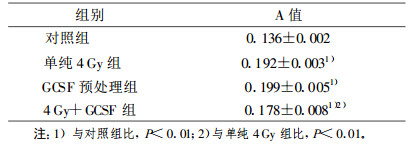
2.2 不同处理组细胞的增殖检测(第30代)(表 2)|
|
表 2 不同处理组细胞的增殖检测(第30代) |
在保证培养条件、接种细胞量、观察时间一致的条件下, 4组细胞(第30代)之间总体生长趋势差异有统计学意义(表 2)。其中60Co γ射线照射组(单纯4 Gy组)和GCSF预处理组变化最显著, 其增殖速度明显提高, 与对照组比, 差异均有极显著性(P < 0.01)。但这两个组之间比较, 其增殖速度差异无显著性(P>0.05)。60Co γ射线照射后再用GCSF持续处理的细胞(4 Gy+GCSF组)与对照组比增殖能力虽然显著增强(P < 0.01), 但较单纯4 Gy组和GCSF预处理组降低(P < 0.01)。
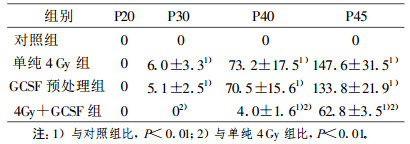
2.3 不同处理组的软琼脂克隆形成率(CFE)(表 3)|
|
表 3 不同处理组的软琼脂克隆形成率(‰) |
分别收集各组传至20、30、40、45代的细胞, 其CFE测定结果见表 3。对照组细胞始终无克隆形成, 单纯4 Gy组和GCSF预处理组均在第30代开始出现克隆, 随传代次数增加, 细胞CFE增高, 说明细胞锚着独立性生长特性随代龄而增强, 提示细胞转化率增加和恶性程度加重。而4 Gy+GCSF组细胞在第40代出现克隆, 比4 Gy组和GCSF预处理组晚了10代。
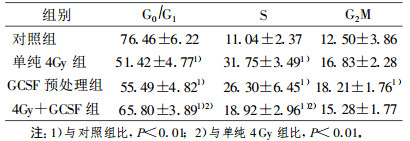
2.4 不同处理组对细胞周期的影响(表 4)|
|
表 4 不同处理组对细胞周期的影响 |
对不同处理组第40代细胞的细胞周期时相进行检测, 结果见表 4。经单纯4 Gy照射后获得的恶性转化细胞G0/G1期细胞周期比例明显降低, 而S期细胞明显增加, 与对照组比差异均有统计学意义(P < 0.01)。GCSF预处理组的细胞其周期变化与单纯4 Gy组相似。而经GCSF处理后的4 Gy照射组细胞(4 Gy +GCSF组) G0/G1期细胞增至65.80%, 比4 Gy组增加了28%, 而S期细胞降至18.92%, 比4 Gy组降低了40%, 与单纯4 Gy组比较, 差异均有极显著性(P < 0.01)。
3 讨论干细胞因子、白细胞介素3、粒巨噬细胞集落刺激因子、G-CSF和巨噬细胞集落刺激因子是一组被称之为造血细胞因子的糖蛋白。这些细胞因子调节造血祖细胞的生长和分化, 并且可增强成熟中性粒细胞和巨噬细胞的功能。研究表明一些肿瘤细胞已发现有这些造血细胞因子的受体, 并发现有这些因子的表达, 最近的研究表明这些因子可促进肿瘤细胞增殖[1]。但G-CSF对于不同肿瘤细胞作用往往不同, 它能促进骨肉瘤细胞MG63[2]、膀胱癌细胞增殖[3], 在皮肤鳞癌细胞中发现了G-CSF和GM-CSF的表达, 这种自分泌可刺激肿瘤生长和迁移[4]; G-CSF能抑制白血病U-937细胞[5]、HL-60[6]细胞增殖; G-CSF可通过促进肿瘤内血管生成从而促进Lewis肺癌荷瘤小鼠的肿瘤生长, 但不能促进体外Lewis肺癌细胞的增殖[7], Westphal G等亦报道, G-CSF对多种肿瘤, 甚至是有GCSF受体表达的肿瘤细胞均无促进增殖作用[8]。所有上述研究均是针对G-CSF对癌细胞的作用, 但G-CSF对正常细胞的恶性转化过程是否起促进作用尚未见报道。
体外细胞转化实验可模拟整体致癌的启动和促进阶段, 因此被广泛应用于致癌剂、促癌剂的检测和致癌机理的研究。通过体外细胞转化过程中一系列特征性变化, 如增殖能力、存活能力、细胞周期时相、锚着独立性生长及裸鼠成瘤性等能够很好显示出肿瘤发生的过程。在本研究中, G-CSF对正常Wistar大鼠肺细胞和单纯4Gy照射后传代的第30代大鼠肺细胞处理3天后, 均未对其增殖产生影响。但60Co γ射线照射后再用G-CSF持续处理的细胞(4Gy+G-CSF组)较单纯4Gy照射传代的细胞其增殖能力有所下降, 说明G-CSF仍有一定的抑制增殖的作用, 并且其抑制作用与处理时间有关。细胞获得非贴壁依赖性, 能在软琼脂介质中形成集落是细胞发生恶性转化的重要标志, 与裸鼠成瘤性有很好的一致性。而在第40代出现克隆, 比单纯4 Gy组晚了10代。说明G-CSF能减缓细胞的恶性转化过程。致癌过程是一个细胞周期失控的过程, 运用流式细胞术发现经4 Gy60Co γ射线照射后传代的细胞DNA合成显著增加, 具有细胞分裂增殖加速特性, 而60Co γ射线照射后再用G-CSF持续处理的细胞(4 Gy+G-CSF组) G0/G1期比例比单纯照射组明显增高, 同时S期细胞数目明显降低, 显示G-CSF能使进入细胞周期的细胞减少, 使细胞周期进程减慢。GCSF预处理组细胞在本实验中结果与单纯4 Gy结果相似, 可能与其处理时间较短有关。综上所述, 可看出G-CSF能减缓细胞的恶性转化过程。我们下一步的工作将进一步探讨其作用机理。
| [1] |
Mroczko B, Szmitkowski M. Hematopoietic cytokines as tumor markers[J]. Clin Chem Lab Med, 2004, 42(12): 1347-1354. |
| [2] |
Thacker JD, Dedhar S, Hogge DE. The effect of GM-CSF and GCSF on the growth of human osteosarcoma cells in vitro and in vivo[J]. Int J Cancer, 1994, 56(2): 236-243. DOI:10.1002/(ISSN)1097-0215 |
| [3] |
Tachibana M, Miyakawa A, Tazaki H, et al. Autocrine growth oftransitional cell carcinoma of the bladder induced by granulocytecolony stimulating/factor[J]. Cancer Res, 1995, 55(15): 3438-3443. |
| [4] |
Obermueller E, Vosseler S, Fusenig NE, et al. Cooperative autocrine and paracrine functions of granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor in the progression of skin carcinoma cells[J]. Cancer Res, 2004, 64(21): 7801-7812. DOI:10.1158/0008-5472.CAN-03-3301 |
| [5] |
Lindermann A, Ridel D, Oster W, et al. Recombinant human granulocyte-macrophage colony-stimulating factor induces secretion of autoinhibitory monokines by U-937 cells[J]. Eur J Immunol, 1998, 18(3): 369-375. |
| [6] |
徐文华、王弘、孙立荣. 重组人粒细胞集落刺激因子对HL-60细胞影响的研究[J]. 医学分子生物学杂志, 2005, 2(3): 178-180. DOI:10.3870/j.issn.1672-8009.2005.03.006 |
| [7] |
Okazaki T, Ebihara S, Asada M, Kanda A, et al. Granulocyte colony-stimulating factor promotes tumor angiogenesis via increasing circulating endothelial progenitor cells and Gr1+CD11b+cells in cancer animal models[J]. Int Immunol, 2006, 18(1): 1-9. |
| [8] |
Westphal G, Niederberger E, Blum C, Wollman Y, et al. Erythropoietin and G-CSF receptors in human tumor cells:expression and aspects regarding functionality[J]. Tumori, 2002, 88(2): 150-159. DOI:10.1177/030089160208800214 |