辐射可引起肾纤维化, 并发展为慢性进展性肾功能衰竭[1]。近年来对放射性肾纤维化的发病机理研究较多, 主要集中在体外纤维原细胞和单侧肾在接受大剂量X射线和γ射线照射后相关细胞因子和细胞外基质成分(ECM)变化规律等方面[1~4], 对中子辐射引发的生物效应研究鲜见报道。因此, 有必要对中子照射后细胞外基质成分的效应加以研究, 为相关损伤的防治提供依据。
1 材料与方法 1.1 仪器设备中子源为锎源(252Cf), 尺寸为直径7 mm、15 mm, 剂量率为0.021 mGy min。
1.2 材料 1.2.1 大鼠Wistar雄性鼠, 体重为(170 ±14)g, 随机分4组, 每组6只。
1.2.2 测定用试剂盒透明质酸(HA)放射免疫分析试剂盒、层粘连蛋白(LN)放射免疫分析试剂盒、Ⅲ型前胶原(PCⅢ)放射免疫分析试剂盒均为上海海研医学生物技术中心产品。
1.3 大鼠照射中子射线照射采用累积剂量照射法, 动物距离中子源中心距离为50cm, 每天照射15h。各实验组累积照射剂量分别为0.29 Gy、0.62 Gy、1.21 Gy。照射时, Wistar大鼠置于一仅容其转身的小笼中。
1.4 大鼠肾组织细胞的分离大鼠拉颈致死, 浸入75 %酒精中约2 min, 取出, 打开腹腔, 剪取肾组织, 移入消毒过的青霉素小瓶中; 剪碎组织, 加1 ml胶原酶(0.5 mg ml), 37 ℃消化2 h; 将上述消化液上清部分转入离心管中, 加10 ml生理盐水, 混匀, 1 000 rpm离心5 min; 沉淀的细胞部分加Hanks液10 ml, 混匀后如上离心; 沉淀的细胞部分加5 ml DMEM培养基, 混匀计数, 稀释。
1.5 细胞培养细胞按量加入24孔细胞培养板, 1 ×106个孔, 37 ℃, 5 %CO2培养36 h, 更换培养基, 再培养24 h, 改用无血清培养基培养24 h。取培养上清液, -30 ℃保存。
1.6 细胞外基质成分定量细胞上清中的细胞外基质成分均采用放射免疫分析方法定量, 具体操作遵照试剂盒的操作说明书进行。
1.7 实验数据处理采用配对t-检验(双样本异方差假设)。同组大鼠的组织细胞分别培养3复孔; 结果以每个剂量组的所有测定数据做统计学处理。统计值以均数±标准差表示(x±s)。
2 结果 2.1 中子照射对大鼠肾组织细胞分泌透明质酸的影响与对照组相比, 0.62 Gy组的HA明显降低(P < 0.05);而0.29Gy组和1.21Gy组的HA水平变化不明显(P >0.05)。0.29 Gy组和1.21 Gy组的HA测定质值比0.62 Gy组的显著增高(P < 0.01)(见表 1)。
|
|
表 1 不同剂量中子对肾细胞分泌HA的影响 |
与对照组相比, 0.62 Gy组的LN变化不明显(P >0.05);而0.29 Gy组和1.21 Gy组的LN显著升高(P < 0.01)。0.29 Gy组和1.21 Gy组的LN测定质值比0.62 Gy组的显著地高(P < 0.01)(见表 2)。
|
|
表 2 不同剂量中子对肾细胞分泌LN的影响 |
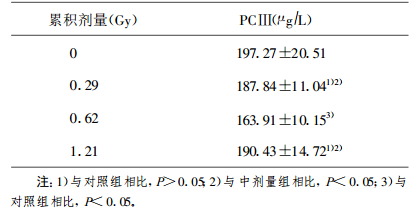
与对照组相比, 0.62 Gy组的PC Ⅲ水平明显低(P < 0.05);而0.29 Gy组和1.21 Gy组的PC Ⅲ变化不明显(P >0.05)。0.29 Gy组和1.21 Gy组的PCⅢ测定质值比0.62 Gy组的显著高(P < 0.05)(见表 3)。
|
|
表 3 不同剂量中子对肾细胞分泌PCⅢ的影响 |
中子主要由反应堆、加速器、实验研究和在临床上治疗恶性肿瘤用的中子源产生, 在战时可由原子弹、氢弹及中子弹等核武器爆炸时产生。目前, 对中子辐射损伤的分子机制及特点还不甚明了, 因此开展中子辐射损伤生物效应特点、分子病理机制研究对损伤防治尤为重要。本研究发现, 大鼠肾组织细胞表达分泌细胞外基质成分的能力随中子辐射的累积剂量不同而变化, 随基质成分不同而变化。0.29 Gy和1.21 Gy的中子对HA和PC Ⅲ的影响不明显, 但都显著刺激LN的增加; 0.62 Gy的中子可显著抑制HA和PC Ⅲ, 对LN的影响却不明显。但是, 就所研究的三种基质成分而言, 中子影响的量效规律有着一致性, 均表现为中剂量(0.62 Gy)组的测定值比低剂量组和高剂量组的测定值低(见图 1)。

|
图 1 中子辐射对大鼠肾细胞表达ECM成分的影响 |
中子照射虽属于高LET辐射, 但是其生物损伤效应特征与γ射线和X射线的相似。照射后细胞外基质成分的变化并不一定遵从剂量依赖性效应规律。用X射线照射小鼠后14 d, 5 Gy组肺组织Ⅰ/Ⅲ型胶原mRNA的比例升高, 而12.5 Gy组肺组织Ⅰ/Ⅲ型胶原mRNA的比例则降低[5]。大鼠经中子照射后, 肺组织Ⅳ型胶原和Ⅲ型前胶原的剂量效应和恢复规律也存在类似的剂量效应背离现象。
照射后细胞外基质成分表达呈现出的复杂现象, 一方面是因为基因表达受射线诱发的细胞因子的调控, 而不是射线的直接效应, 另一方面, 表达出的细胞外基质成分又受相关水解酶的调控[6]。射线除了直接地损伤遗传物质外, 还通过激发生成氧自由基或氮自由基引起次级损伤, 次级损伤通过TGF-β1[7]、PAI- 1[4]等细胞因子引发间质细胞转化为肌性成纤维细胞, 从而造成组织的ECM平衡被破坏。所以, ECM成分的大量表达是射线的间接效应, 其影响因素和表达规律均较复杂。
| [1] |
杨振国, 王德文, 宋良文, 等. 吸入一氧化氮对放射性肺纤维化中细胞因子及丝裂原物质变化的影响[J]. 辐射研究与辐射工艺学报, 2002, 20(2): 151-157. DOI:10.3969/j.issn.1000-3436.2002.02.013 |
| [2] |
Ina K, Kitamura H, Tatsukawa S, et al. Transformation of interstitial fibroblasts and tubulointerstitial fibrosis in diabetic nephropathy[J]. Med Electron Microsc, 2002, 35(2): 87-95. DOI:10.1007/s007950200011 |
| [3] |
Robbins M E, O'Malley Y, Zhao W, et al. The role of the tubulointerstitium in radiation-induced renal fibrosis[J]. Radiat Res, 2001, 155(3): 481-489. DOI:10.1667/0033-7587(2001)155[0481:TROTTI]2.0.CO;2 |
| [4] |
Oikawa T, Freeman M, Lo W, et al. Modulation of plasminogen activator inhibitor-1 in vivo:a new mechanism for the anti-fibrotic effect of renin-angiotensin inhibition[J]. Kidney Int, 1997, 51(1): 164-172. DOI:10.1038/ki.1997.20 |
| [5] |
Rosenbaum D, Peric S, Holece KM, et al. Hyaluronan in radiation-induced lung disease in the rat[J]. Radiat Res, 1997, 147(5): 585-591. DOI:10.2307/3579625 |
| [6] |
Shao C, Aoki M, Furusawa Y. Bystander effect in lymphoma cells vicinal to irradiated neoplastic epithelial cells:nitric oxide is involved[J]. J Radiat Res, 2004, 45(1): 97-103. DOI:10.1269/jrr.45.97 |
| [7] |
Zhao W, O'Malley Y, Robbin ME. Irradiation of rat mesangial cells alters the expression of gene products associated with the development of renal fibrosis[J]. Radiat Res, 1999, 152(2): 160-16. DOI:10.2307/3580089 |