2. 第三军医大学复合伤全军研究所, 重庆 400038
染色质DNA是电离辐射损伤细胞的主要靶点, 电离辐射作用于细胞之后, 经细胞内以P53为核心所构成的的报警系统向细胞传达损伤信号, 引起细胞增殖抑制、周期阻滞、细胞凋亡等生物学效应[1]。近年来的研究表明, 细胞膜也是细胞辐射损伤的靶点[2]。细胞膜是外界信息传递的起点, 膜上不仅存在细胞生存信号受体, 如生长因子信号传递的酪氨酸激酶受体, 也存在细胞凋亡信号传递的死亡受体[3]。电离辐射作为一种贯穿性损伤因子, 当其作用于细胞时, 必将对生物膜的结构与功能产生影响。因此我们观察了不同剂量照射及照射后不同时间BET-2细胞细胞膜凋亡通路激活与细胞凋亡发生之间的关系, 以探讨细胞膜损伤在辐射防护中的意义。
1 材料与方法 1.1 试剂Annexin-V-FLUOS凋亡分析试剂盒购自Boehringer Mannheim公司, caspase-8、caspase-3试剂盒、caspase-8抑制剂IETD-fmk购自CLONTECH公司。
1.2 细胞培养及照射BET-2细胞为小鼠源性EPO依赖细胞株, 本实验室保存。RhEPO由军科院五所提供, 活性为2 000 U/ml, 纯度98 %。以适当数量的细胞接种于含10 %胎牛血清的RPMI1640培养基中, 加入EPO, 终浓度为2 U/ml, 隔日换液一次。指数生长期细胞一次均匀照射, 照射剂量0、1、3、5、7、10 Gy, 剂量率154.3 cGy/min。照射后分为照射组与处理组, 处理组中按50 μM加入caspase-8特异性抑制剂IETD-fmk, 继续培养。
1.3 检测方法 1.3.1 MTT方法将待测细胞用RPMI 1640培养液洗涤3次, 台盼兰染色计数活细胞, 用10 %胎牛血清的RPMI1640培养基调整细胞浓度为3×105/ml, 每孔100 μl加入96孔板中; EPO倍比递减稀释后, 每孔加入100 μl, 每组做3个复孔, 37 ℃、5 %CO2培养48 h, 加MTT(50mg/ml)20 μl, 继续培养4 h, 离心、吸弃上清, 加入200 μl DMSO, 振荡助溶, 在MODEL 550酶联仪(BIORAD)上测492 nm、630 nm波长的OD值, 以EPO浓度对数为横坐标, 以细胞OD值为纵坐标绘图。
1.3.2 caspase-8、caspase-3酶活性检测[4]在各时相点收集细胞, 分别按caspase-8、caspase-3试剂盒说明书进行。在各时相点收集2×106细胞, 200 g离心10 min; 加入50 μl预冷的细胞裂解液, 冰上孵育10 min; 4 ℃, 12 000 rpm离心3 min, 上清转入另一离心管; 设立对照组, 加50 μl 2×反应缓冲液(含DTT), 再加5 μl反应底物, 37 ℃水浴1 h; 以未照射细胞为正常对照, 加入抑制剂为空白对照, 用Bio-rad 550型酶联仪测定405 nm波长的OD值。
1.3.3 Annexin-V法检测[5]按Annexin-V-FLUOS凋亡分析试剂盒说明书进行:细胞诱导凋亡之后(照射), 取约1×106细胞, PBS洗涤, 200 g×5 min离心, 弃尽上清, 细胞重悬于100 μl Annexin-V-FLUOS标记缓冲液(1 000 μl溶液Ⅲ中预先加入20 μl Annexin-VFLUOS单抗及20 μl 50 μg/ml PI)中, 避光, 室温放置10~15 min, 加溶液Ⅲ(100 mM Hepes/NaOH, pH 7.4, 140 mM NaCl, 5 mM CaCl2)0.4 ml, 上机检测。
1.4 统计分析应用ORIGIN软件中logistic程序对每条曲线进行拟合处理分析。
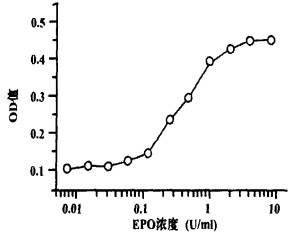
2 结果 2.1 BET-2细胞对EPO增殖反应性BET-2细胞为小鼠源性EPO依赖细胞株, 需要在外源性的EPO存在下才能存活、增殖。图 1示BET-2细胞对EPO的增殖反应性。培养基中EPO < 0.2 U/ml时, 细胞增殖停止; 浓度在1~4 U/ml时, 细胞增殖良好; 而当浓度>4 U/ml时, 其促进BET-2细胞的增殖能力已达饱和状态(见图 1)。表明BET-2细胞EPO有较好的依赖性, 该细胞生物学特性稳定。
|
图 1 BET-2细胞对EPO增殖反应性 |
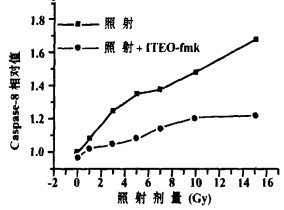
在照射后1~3 hBET-2细胞内caspase-8即开始升高, 9 h达高峰, 以后逐渐下降(见图 2); caspase-8的改变与照射剂量呈正相关。照射后加入caspase-8特异性抑制剂IETD-fmk, 可完全阻断caspase-8的活性(见图 3)。
|
图 2 不同剂量照射后9h BET-2细胞Caspase-8活性比 |

|
图 3 7 Gy照射后不同时间BET-2细胞Caspase-8活性比 |
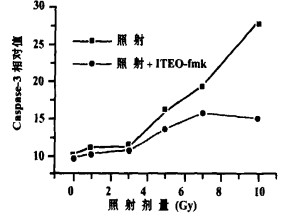
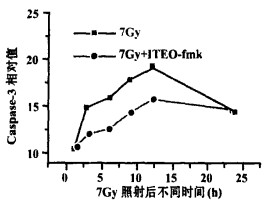
在照射后3 h caspase-3开始升高, 12 h达高峰, 以后逐渐下降(见图 4); caspase-3的改变与照射剂量呈正相关。照射后加入caspase-8特异性抑制剂IETDfmk, 仅在一定程度上减少受照细胞的caspase-3, 而未能达到完全保护的效果(见图 5)。
|
图 4 不同剂量照射后12 h BET-2细胞Caspase-3活性比 |
|
图 5 7Gy照射后不同时间BET-2细胞Caspase-3活性比 |
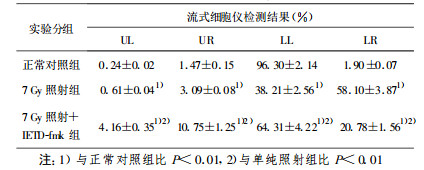
正常BET-2细胞增殖状态良好(存活细胞≥96.30 %)。7Gy照射后12 h, 细胞发生凋亡, 细胞膜发生改变失去对称性, 细胞膜内侧的磷脂酰丝氨酸(PS)外翻, 和Annexin-V特异结合[6], LL象限细胞(存活细胞)仅为38.21 %, LR象限细胞(凋亡细胞)达到58.10%(与正常对照组比P < 0.01);照射后即刻加入caspase-8特异性抑制剂IETD-fmk, 细胞存活率为64.31 %, 细胞凋亡率为20.78 %, 表明可在一定程度上减少细胞凋亡(与单纯照射组比P < 0.01), 但未能达到完全保护的效果(与正常对照组比P < 0.01, 见表 1)。
|
|
表 1 7 Gy +IETD-fmk处理后12 h BET-2细胞Annexin-V检测结果 |
细胞凋亡是细胞内部精细调节的过程, 首先有凋亡信号的传入, 经细胞内信号系统整合后, 引起细胞的caspase等酶解机制的激活, 导致各个细胞器逐一被拆卸(disassembly), 最终被体内的吞噬细胞清除[7]。细胞死亡受体分为TNFR1、Fas、DR3、DR4和DR5等五种, 当死亡受体与他们各自的配体结合后, 通过受体胞内长约80个氨基酸的死亡结构域(death domain), 募集FADD等多种介导细胞凋亡的蛋白, 启动细胞膜受体凋亡信号通路。其中caspase-8是该通路的引发因子(initiator), 可激活下游的caspase-3等效应子(effector), 导致细胞凋亡[3]。既往认为在该通路的激活过程中, 与死亡受体特异结合的配体是必不可少的。然而近来的研究表明, 化疗药物、紫外线、电离辐射等应激因子作用于细胞, 可导致细胞在无Fas-L等配体存在的状况下直接作用于细胞死亡受体, 激活细胞凋亡信号通路[8, 9]。阻断细胞凋亡信号通路之后, 细胞凋亡明显减少[10]。
本研究结果表明, BET-2细胞在受60Coγ射线照射后约1 h左右即开始出现caspase-8活性升高, 在照射后9 h达高峰, 随后逐渐下降; 在加入caspase-8特异性抑制剂IETD-fmk后, caspase-8的活性完全受到了抑制; caspase-3在受照后3 h左右活性升高, 照射后12 h达高峰, 随后逐渐下降; 在加入caspase-8特异性抑制剂IETD-fmk后, caspase-3的活性受到一定抑制。在照射后12 h检测细胞存活率仅为38.21 %, 细胞凋亡达到58.10 %(与正常对照组比P < 0.01);7 Gy照射+IETD-fmk组细胞存活率增到64.31 %, 细胞凋亡降为20.78 %(与照射组比P < 0.01)。
电离辐射后caspase-8激活无需死亡配体Fas-L等的存在, 表明辐射可直接作用于细胞膜, 激活细胞凋亡的膜受体-caspase-8途径, 导致细胞凋亡。因此保护细胞膜、抑制细胞膜死亡受体通路信号传递在辐射防护中有一定的治疗价值。同时也提示, 该途径的激活并非辐射诱导细胞凋亡的唯一通路, 因为照射后加入caspase-8特异性抑制剂IETD-fmk, 完全阻断caspase-8活性的情况下, 细胞的caspase-3活性仅被部分抑制, 未能完全阻止辐射细胞走向凋亡, 这与电离辐射信号传递的多条通路激活有关。
在电离辐射损伤的信号转导过程中, 不仅作用于染色质DNA, 细胞膜也是辐射损伤的重要靶点之一。多信号通路激活、多靶点作用, 是电离辐射损伤的基本特点。因此在设计防治方案时应有全局的观念, 单从损伤机制的某一方面入手, 很难达到理想的效果; 抑制电离辐射对细胞膜信号通路的激活, 为研究肿瘤的放化疗机理和寻找新的辐射防护治疗方法提供新思路。
| [1] |
Irena Szumiel.Monitoring and signaling of radiation-induced damage in mammalian cells[J].Radiation Research.150(Suppl): S92-S101.
|
| [2] |
Adriana Haimovitz-Friedman.Radiation-induced signal transduction and stress response[J].Radiation Research.150(Suppl): S102-S108.
|
| [3] |
Arjun Singh, Jian Ni, Bharat B.et al.Death domain receptors and their role in cell demise[J].Journal of Interferon and Cytokine Research, 18: 439-450.
|
| [4] |
Gold R, Schmied M, Giegerich G, Breitschopf H, et al. Differentiation between cellular apoptosis and necrosis by the combined use of in situ tailing and nick translation techniques[J]. Lab Invest, 1994, 71: 219--225. |
| [5] |
Detlef Bartkowiak, Stephanie Hogner, Heinrich Baust. Comparative analysis of apoptosis in HL60 detected by annexin-v and fluorescein-diacetate[J]. Cytometry, 1999, 37: 191-196. DOI:10.1002/(ISSN)1097-0320 |
| [6] |
Valerie A.Fadok, Donna L.Bratton, David M.Rose, et al.A receptor for phosphatidylserine-specific clearance of apoptotic cells [J].Nature, 405: 85-92.
|
| [7] |
Guy S.Salvesen and Vishva M.Dixit.Caspases: intracellular signaling by proteoly sis[J].Cell, 91: 443-446.
|
| [8] |
Ultraviolet light induces apoptosis via direct activation of CD95(Fas APO-1) independently of its ligand CD95L[J].The Cell of Biology, 140: 171-182.
|
| [9] |
Elizabeth A.Reap.Kevin Roof, Kenrick Maynor, Mchelle Borrero, et al.Radiation and Stress-induced apoptosis: a role for Fas Fas-ligand interactions.Pro[J].Natl.Acad.Sci.USA.94: 5750-5755.
|
| [10] |
J.S.Braun, R.Novak, K.H.Herzog, et al.Neuroprotection by a caspase inhibitor in acute bacterial meningitis[J].Nature Medicine, 5, 298-320.
|