细胞凋亡(apoptosis)或称程序性细胞死亡, 是细胞接受某种信号或受到某些因素刺激后一种主动的、由一些凋亡相关基因相互作用的细胞消亡过程, 是细胞自然的生理性死亡形式。国内外许多研究表明辐射具有诱导细胞凋亡的作用; 作为第二信使的Ca2+在信号传导中具有重要作用。正常情况下, 细胞质中的Ca2+浓度很低, 而细胞外, 线粒体和内质网中的Ca2+是细胞质的数倍。新近的研究已经表明Ca2+浓度的增加或细胞内Ca2+分布混乱可引起细胞调亡或细胞死亡[1]。本实验给体外培养的HL- 60细胞胞外不同浓度的Ca2+, 观察其凋亡情况, 报道如下。
1 材料和方法 1.1 主要试剂Na2H32PO4由中国原子能研究所提供, RMPI1640培养基、新生小牛血清购于GBICO公司, 其余试剂均为国产分析纯。HL-60细胞株由广东医学院儿科研究所提供。
1.2 细胞培养将对数生长的HL-60细胞接种于培养瓶内, 用含15 %新生小牛血清, 1%HEPES, 100u/ml青霉素及100 u/ml链霉素的RMPI1640培养基于37 ℃, 5%CO2饱和湿度的培养箱内传代培养。
1.3 实验设计取对数生长期细胞, 实验前做台盼兰染色, 活细胞数需大于98%。各取2 ml细胞悬液于培养瓶内, 加入经培养基稀释的32P, 使终浓度为3.7×106 Bq/ml(0.10 mCi ml), 实验设6瓶, 第一瓶为对照组, 不加Ca2+, 余依次加入不同浓度的CaCL2, 使Ca2+终浓度分别为0.05、0.25、0.50、2.50和4.50 mmol L; 作用24 h和48 h后分别上机检测凋亡率。
1.4 流式细胞仪检测凋亡率将处理后的细胞离心重悬后, 取0.5 ml用4 ml 70 %冷乙醇固定, 放入4 ℃冰箱12 h, 染色前将细胞用磷酸-柠檬酸缓冲液洗涤3次, 调整细胞数量至0.5×106 lmb, 加入碘化丙啶(PI 50 μg/ml)0.5 ml, 4℃避光染色30 min, 用COULTER公司Epics-XL型流式细胞仪检测。
1.5 统计学处理采用SAS8.0统计软件。
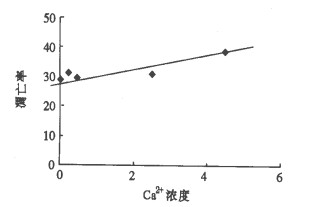
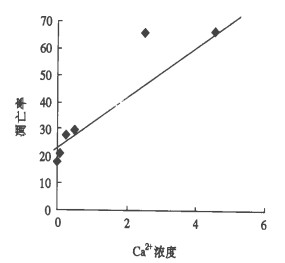
2 结果Ca2+处理细胞24 h后, 细胞凋亡率随Ca2+浓度的增加而增大, 有正相关性, r=0.9001 (P=0.0145)。Ca2+处理细胞48 h后, 细胞凋亡率随Ca2+浓度的增加而增大, 有正相关性, r =0. 9343(P =0.0063)。细胞凋亡率见表 1直线相关图见图 1、图 2。
|
|
表 1 不同浓度的Ca2+作用24和48 h对辐射诱导HL-60细胞凋亡率的影响(%) |
|
图 1 辐射诱导HL-60细胞24 h后凋亡率与Ca2+浓度的回归曲线 回归方程:Y =1.7811X +28.851 r =0.9001(P <0.05) |
|
图 2 辐射诱导HL-60细胞48 h后凋亡率与Ca2+浓度的回归曲线 回归方程:Y=11.2762X +23.4743 r=0.9343(P <0.01) |
许多研究认为Ca2+与细胞凋亡的两个主要阶段即凋亡过程的起始阶段和凋亡的最后通路Ca2+依赖性核酸内切酶的激活有关。在碱性环境下, 游离Ca2+浓度达到足以激活碱性核酸内切酶时可启动基因组DNA的降解, 但许多实验结果显示凋亡细胞的细胞内游离钙离子浓度比这一水平低1 000 ~ 10 000倍, 提示钙离子在细胞诱导凋亡中可能更多的是参与了信息传递。正常情况下胞外Ca2+变化引起胞内Ca2+变化的机制尚不清楚, 文献报道[2] Ca2+通道作为细胞膜的重要Ca2+转运体系, 存在两个解离常数不同的亲和位点, 通道亲和位点与Ca2+的结合与胞外Ca2+浓度密切相关。大量实验表明, 很多细胞在凋亡早期会出现细胞质内Ca2+浓度迅速持续的升高[2], 这种浓度升高来源于细胞外Ca2+的内流及胞内钙库的释放, 相对高浓度的Ca2+不仅可激活胞质中的钙依赖性蛋白酶, 而且可以作用于线粒体, 影响其通透性的改变, 进而促进凋亡。由于辐射可致胞膜的损伤, 细胞内Ca2+库的打开, 使胞质中的Ca2+升高, 同时辐射可引起跨膜动作电位变大, 离子通道失控, 大量离子可以穿过离子通道实现跨膜运输, 细胞外Ca2+大量流入细胞内, 导致细胞内钙离子浓度显著升高诱导细胞凋亡, 细胞外Ca2+的跨膜内流是经过Ca2+通道(如二氢吡啶受体、Ca2+储存控制通道、电压门孔通道)与Na+/Ca2+交换体实现的, 辐射可使膜受体激活或膜蛋白结构变化, 使这些通道打开, 导致Ca2+内流。本实验显示, 不同Ca2+浓度处理等剂量辐射的HL-60细胞后24 h, 细胞凋亡率随Ca2+浓度的增加而增大, 有明显的正相关性, 说明Ca2+在辐射诱导细胞凋亡中起着十分关键的作用, 不仅仅是信号转导, 而是Ca2+通过细胞膜, 激活相应的蛋白和受体, 启动凋亡程序, 进入细胞核, 激活核酸内切酶, 使细胞DNA断裂。正常情况下, 线粒体和内质网中的Ca2+浓度要比细胞质中的高很多, 因而Ca2+轻微的释放便能使细胞质内的Ca2+浓度大幅度的提高, 从而激活各种Ca2+依赖性激酶, 但从本实验结果显示, 以胞外Ca2+的内流为主或是胞外、胞内钙库释放的共同结果促进了辐射诱导细胞凋亡率的增加。Ca2+作用48 h后, 凋亡率增加趋势相对平缓, 说明凋亡细胞处于相对平稳状态, 可能是由于离体培养细胞没有来自与机体全身因素的作用, 或由于Ca2+浓度过高形成Ca2+“超载”, 导致细胞大量死亡。
| [1] |
Orrenius S, Zhivotovsky B, Nicotera P. Calcium:Regulation of cell death:the calcium-apoptosis link[J]. Nat Rev Mol Cell Biol, 2003, 4(7): 552-565. DOI:10.1038/nrm1150 |
| [2] |
梁润酶, 董惠文. 钙通道[J]. 生命的化学, 1994, 14(5): 23-25. |
| [3] |
Bemdge MJ, Lipp P, Bootman MD. The versatility and universality of calcium signaling[J]. Nature, 2000, 1: 11-21. |



