80 %~ 90%的人类癌症起自上皮组织, 因此以上皮细胞为靶细胞来研究致癌机理具有重要的理论及实际意义。大鼠气管-支气管上皮细胞是研究氡及其子体致肺癌机理及放射毒理学的良好模型, 上皮细胞的分离和培养是进行后续研究的关键。获得大鼠气管-支气管上皮细胞的常用方法是链酶蛋白酶消化法[1], 但该法在细胞收获量、纯度和成活率等方面尚存在不足。本研究联合应用链酶蛋白酶消化加细胞刷刷洗法提取大鼠气管-支气管上皮细胞, 以获得适用于后续研究的细胞数量和质量, 以得到可以更好支持上皮细胞较长时间增殖的改良培养体系。
1 材料和方法 1.1 试剂和仪器链酶蛋白酶、牛垂体提取物、牛血清白蛋白、磷酸乙醇胺、胰岛素、转铁蛋白、氢化可的松均为Sigma产品, 丙酮酸钠由苏州大学设备处领取。Pan cytokeratin、Goat anti mouse IgG-FITC、DAPI由博士德有限公司购入。Ham' s F12培养基系Gibco产品。细胞刷由李冰燕老师赠送。培养皿为Corning产品。倒置显微镜是Olympus产品。激光共聚焦显微镜为Leca TCS SPZ CLSM。
1.2 气管-支气管无血清完全F12培养基的制备气管-支气管无血清完全F12培养基是由Ham' s F12培养基补以5 μg/ ml牛垂体提取物, 3 mg /ml牛血清白蛋白, 5 μg/ ml上皮生长因子, 50 μmol/l磷酸乙醇胺, 50 μg/ ml胰岛素, 50 μg/ ml转铁蛋白, 0.3 μmol/l氢化可的松, 2 mmol l的丙酮酸钠。
1.3 气管-支气管上皮细胞的分离7 ~ 8周的雄性Wistar大鼠5只, 3.6%水合氯醛麻醉后, 无菌条件下暴露气管和肺, 环状软骨下方插管, 生理盐水灌洗3次, 下端在左右肺门处结扎, 去除肺组织, 然后灌入1 %链酶蛋白酶, 结扎上端, 4℃过夜, 置于90 mm培养皿中, 用Ham' sF12培养基冲洗气管-支气管, 再剪开气管-支气管用细胞刷充分刷洗, 4号针头收集培养皿中的刷洗液, 离心洗涤收集细胞。取0.1 ml细胞悬液, 台盼蓝染色后计数, 计算存活率。
1.4 气管-支气管上皮细胞的鉴定及纯度分离得到的气管-支气管上皮细胞, 以1 ×105个接种于预先放置两张盖玻片和无血清完全F12培养基的60 mm培养皿内, 24 h后, 弃培养液, 收集两张爬片, 4%多聚甲醛固定30 min, 再经梯度甲醇复水, PBS洗涤三次, 一张爬片加Pan cytokeratin, 另一张做对照加双蒸水, 37 ℃孵育1.5 h, PBS洗涤三次, 再加Goat anti mouse IgGFITC避光作用30 min, PBS洗涤三次, 然后用DAPI染色30 min, PBS洗涤后在激光共聚焦显微镜下观察, 计算纯度。
1.5 气管-支气管上皮细胞的培养分离得到的气管-支气管上皮细胞以1×105个60 mm平皿接种于无血清完全F12培养基中, 37 ℃, 5 %CO2温箱培养, 24 h后取一个培养皿, 弃培养液, 收集贴壁细胞计数, 计算贴壁率, 其余培养皿3 d换液, 5 d传代。
2 结果 2.1 大鼠气管-支气管上皮细胞的分离结果消化后刷洗法分离大鼠气管-支气管上皮细胞的结果见表 1。结果表明, 此法大约可得到1.30 ×106个细胞鼠, 成活率约为84.19%。
|
|
表 1 消化后刷洗法提取大鼠气管-支气管上皮细胞的结果 |
细胞在抗角蛋白抗体作用后, 经FITC和DAPI染色, 在激光共聚焦显微镜下可见, 所有的细胞核呈蓝色荧光, 而胞浆呈绿色荧光或无荧光, 其中胞核呈蓝色荧光胞浆呈绿色荧光的细胞为上皮细胞, 见图 1。计数细胞后, 计算上皮细胞的纯度, 结果见表 1。由结果可见, 经24 h贴壁后, 细胞的纯度约为90.66%。
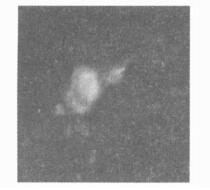
|
图 1 激光共聚焦显微镜下观察到的上皮细胞 |
细胞接种24 h后, 贴壁率约为40.74 %(见表 1)。72 h后, 细胞进入增殖旺盛期, 120 h时倒置显微镜下可观察到上皮细胞岛(见图 2), 传代后直到15 d终止培养, 细胞均生长良好, 未见有明显衰退性改变出现。
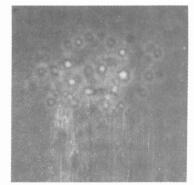
|
图 2 倒置显微镜下观察到的上皮细胞岛 |
分离气管-支气管上皮细胞, 常用的方法有酶消化法、机械刷洗法和消化后刷洗法。秦晓群等人比较研究了这三种方法提取新西兰兔气管-支气管上皮细胞的效果, 发现消化后刷洗能获得足量的细胞并且细胞存活率优于其他方法[2]。本实验采用链酶蛋白酶消化后细胞刷刷洗的方法分离大鼠气管-支气管上皮细胞, 大约可得到细胞1.30 ×106个鼠, 成活率约为84.19 %。采用链酶蛋白酶在上皮细胞侧消化, 使细胞易于分散脱落, 而对细胞本身损伤小, 然后再用细胞刷刷洗, 使基底层的基细胞可大量回收, 从而提高细胞的收获量与存活率。在研究氡及其子体的损伤效应时其靶细胞是支气管上皮基底细胞、黏液细胞。应用此法不仅上皮细胞收获量与存活率高, 而且可得到大量的基细胞。实验结果表明, 消化后刷洗法提取大鼠气管-支气管上皮细胞, 是一种实用的提取方法, 可以满足毒理学实验和培养的要求。
气管-支气管上皮为假复层纤毛柱状上皮, 由纤毛细胞、杯状细胞、刷细胞、基细胞和小颗粒细胞等组成。这些上皮细胞特征性地表达角蛋白, 可用抗角蛋白抗体进行免疫荧光双染色, 在激光共聚焦显微镜下观察细胞的形态和数量, 从而计算纯度。本实验中, 经24 h贴壁后, 细胞贴壁率约为40.74%, 上皮细胞纯度达到90.66%。
研究者们建立了各种方法来支持大鼠气管-支气管上皮细胞的生长。早期, Gray等人用3T3细胞做滋养细胞成功培养了大鼠气管上皮细胞, 并研究了MNNG, γ射线等诱发的克隆形成率、细胞转化等方面的改变[3]。后来Thomassen等人建立了无血清完全F12培养系统, 使其得以广泛使用[1]。国内学者进行的大鼠气管上皮细胞的培养基本上都参照Thomassen建立的方法, 但李红澜等人用加丙酮酸钠和胎牛血清的F12培养基也成功培养了大鼠气管上皮细胞[4]。本实验改进Thomassen的无血清完全F12培养系统, 弃用霍乱弧菌毒素, 添加丙酮酸钠。在一般培养条件下, 气管-支气管上皮细胞的生长期一般为7 d左右, 而在无血清完全F12培养基中, 由于有牛血清白蛋白、牛垂体提取物和上皮生长因子的支持, 细胞生长旺盛, 5 d形成上皮细胞岛后传代, 细胞仍能继续生长, 直到15 d终止培养时仍未见细胞出现明显衰退性改变。因此, 本实验的无血清完全F12培养系统可以使大鼠气管-支气管上皮细胞长时间维持在增殖阶段, 延缓衰退, 增强细胞的生存能力, 从而为该细胞的后续实验研究创造了有利条件。
| [1] |
Thomassen DG, Saffiotti U, Kaighn M E. Clonal proliferation of rat tracheal epithelial cells in serum-free medium and their responses to hormones, growth factors and carcinogens[J]. Carcinogen, 1986, 7(12): 2033-2039. DOI:10.1093/carcin/7.12.2033 |
| [2] |
秦晓群, 孙秀泓, 张长青. 联合应用酶消化和机械刷洗提取气道上皮细胞的实验技术[J]. 湖南医科大学学报, 1999, 24(1): 74-76. |
| [3] |
Gray TE, Thomassen DG, Mass M J, et al. Quantitation of cell proliferation, colony formation and carcinogen induced cytotoxicity of rat tracheal epithelial cells grown in culture on 3T3 feeder layers[J]. In Vitro, 1983, 19(7): 559-570. DOI:10.1007/BF02619604 |
| [4] |
李红澜, 周袁芬, 张瑞稳, 等. 大鼠气管上皮细胞体外培养方法及生长条件[J]. 上海医科大学学报, 1989, 16(3): 234-236. |




