2. 南方医大学医工系
宫颈癌是严重威胁妇女健康的一种疾病, 也是最多见的恶性肿瘤之一, 居我国妇女恶性肿瘤的首位。体外照射和腔内后装治疗相结合长期以来被认为是治疗宫颈癌的标准方法, 宫颈肿瘤原发区的治疗, 以腔内后装治疗为主, 盆腔转移区以体外照射为主。据中国医学科学院肿瘤医院统计表明, 宫颈癌放射治疗失败的患者中, 70%是盆腔内复发, 30%为远处转移, 盆腔内复发者中60 %是宫旁复发, 近40 %是局部复发[1]。有资料表明, 宫颈癌后装腔内治疗后放射性膀胱炎、放射性直肠炎分别达9.3%、20%, 阴道放射性损伤则更为严重[2], 因此, 准确了解宫颈癌腔内后装治疗时各重要器官和组织的实际受照剂量, 对预测放疗副作用、优化放疗计划和提高疗效具有重要价值。笔者采用国产高灵敏度氟化锂[LiF(Mg, Cu, P)]热释光剂量计(TLD)和仿真人体盆腔模型配合, 核查宫颈癌腔内后装治疗三维剂量分布, 探讨JR1152-F型TLD用于后装治疗体内剂量监测的准确度及其应用价值。
1 仪器设备材料所用仿真人体盆腔模型为成都剂量体模, 制作体模用的材料的组织辐射等效在医疗照射范围(60 keV~20 MeV)等效误差小于±2 %, 形态相似参数:按中国成人女性50百分位制作, 围径误差小于2 cm, 脏器中心定位误差小于1.5 cm。北京核仪器厂生产的FJ427-A1型微机热释光剂量仪, FJ411A型热释光退火炉, JR1152-F型热释光剂量计(规格1 mm ×1 mm ×6 mm); 荷兰核通公司生产的micro-Selectron HDR192Ir后装治疗系统, 该系统经广东省剂量检定站检定, 水模体内测量点吸收剂量的重复性为0.1 %, TPS计算的剂量值与水模体中实测吸收剂量的相对偏差为1.0 %; 西门子Primart电子直线加速器(X射线能量6MV), 东芝LX-40A模拟定位机, Farmer 2570剂量仪。
2 方法及结果 2.1 TLD测量升温程序的确定采用慢速线性升方式, 对实验中所用的TLD进行发光曲线的测定:预热温度40 ℃, 预热时间5 s, 读出温度360 ℃, 升温速度2 ℃/s, 升温时间160 s, 退火温度设为400 ℃, 退火时间设为0。测得发光曲线如图 1所示。

|
图 1 TLD测量192Ir的发光曲线 |
根据发光曲线, 本实验中TLD测量的升温程序可定为:预热温度140 ℃, 预热时间20 s、读出温度240 ℃, 读出时间20 s、退火温度300 ℃、退火时间15 s, 所有测量均用同样的升温和退火条件。
2.2 TLD的筛选取JR1152-F型TLD共100条, 彼此紧密相接整齐排列于仿真体模块上, 形成20 mm ×30 mm的矩阵, 再用厚度5 cm的仿真体模块覆盖其上, 用Primart电子直线加速器6MV的X射线进行照射, 射野大小10 cm ×10 cm, 源皮距为100 cm, TLD矩阵位于照射野中心, 加速器剂量特性经广东省剂量检定站检定, 重复性0.1%, 短期稳定性0.7 %, 辐射野对称性1.01%, 用经标定后的剂量仪同时监测, 照射100 MU后, 用退火炉400 ℃退火1 h, 然后自然冷却, 重复照射并测量, 将读数分散性小于±3%的TLD检出备用。
2.3 TLD剂量刻度绝对剂量测量, 须对热释光剂量仪和所使用的探测器进行标定, 即对TLD照射已知剂量, 然后测量读数, 确定读数值与剂量值之间的比例系数。TLD剂量计在退火炉内400 ℃退火1 h, 然后立即取出倒在专用金属盘中快速冷却。
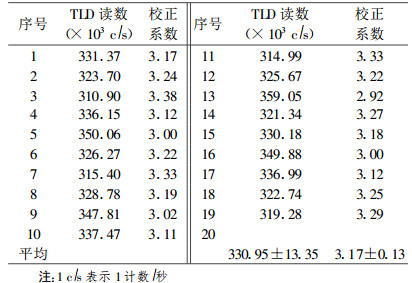
为获得较均匀的192Ir γ辐射场, 设计后装治疗计划, 使放射源按直线驻留, 步进长度为5 cm, 采用外径6 F塑料软管作施源器, 距施源器中心外2 cm处给予参考剂量100 cGy, 经后装TPS优化后, 在施源器外2 cm处可得到一段长度为3 cm, 剂量相对误差小于1.0%的均匀照射区域; 源步进值0.25 cm, 待刻度的TLD剂量计5个为一组, 放于另一条外径同样为6F的施源器中, 固定两施源器, 使其严格平行, 呈直线排列, 两施源器中心相距2 cm, TLD位于3 cm的均匀辐照场区域(相对偏差小于1.0%)。TLD剂量计编号后, 反复照射三次, 取每一剂量计测量值的算术平均值作为该剂量计的读数, 对所有剂量计再取平均值, 从而可得到该组剂量计的刻度系数, 见表 1。
|
|
表 1 TLD的校正系数测量结果 |
照射方式与2.3中所述相似, 照射剂量从20 cGy, 50 cGy到700 cGy, 每次照射5个TLD剂量计为一组, 同时照射, 测量时去掉一个读数最大和一个读数最小值, 取其余三个读数的平均作为相应剂量的测量读数, 见表 2。
|
|
表 2 TLD的剂量响应线性的测量值及拟合值 |
从表 2中可见, 当照射剂量300 cGy内时, 本批剂量计的测量读数值与剂量的关系呈线性关系。对照射剂量在300 cGy内的测量读数进行最小二乘法拟合, 得方程: Y =3.438X + 0.284 9, 相关系数R =0.997当照射剂量大于300 cGy时, 剂量片的测量读数值与剂量的关系呈非线性关系(见图 2)。

|
图 2 TLD线性:测量读数与照射剂量的最小二乘拟合 |
照射方式与2.3中所述相似, 只不过为提高效率, 在放射源所在施源器两侧对称放两组TLD剂量计, 每组五个, 每组测量读数时, 去掉一个读数最大值和最小值, 取其余三个读数的平均值作为单次照射的测量读数, 重复测量五次, 得到十组读数平均值。重复性的计算公式:

|
式中: Ri第i次测量值, R : n次比值的平均, n =10。根据测量结果, 计算得TLD测量剂量的重复性相对偏差±3.9%。
2.6 体模内剂量测量仿真人体盆腔模型分成6段, 在每一段的关键器官上设置若干直径1 mm、长6 mm的测试孔, 孔中放入直径1 mm、长6 mm小铅条, 插入宫腔管施源器, 模机下拍摄正位和侧位X射线定位片。取出铅条, 将经过仔细筛选、编号、刻度和400 ℃退火后的TLD剂量计, 按照编号顺序放入仿真人体模型对应编号的剂量测试孔内, 用microSelectron HDR后装治疗计划系统(TPS)设计腔内放疗模拟计划, 给予A点剂量200 cGy/次, 计算出各测试点的理论值和重建精度, 按计划进行腔内后装照射, 用已刻度的FJ427-A1热释光剂量仪对受照后的TLD剂量计进行测量读数, 同一位置进行三次照射和测量, 结果列于表 3。
|
|
表 3 体模内重要器官受照剂量的实测值和计算值及其相比偏差 |
宫颈癌腔内后装治疗的体内剂量测试, 大多是利用人体的天然管腔进行无创监测, 也有的通过插植进行有创监测, 主要测量方法是用热释光剂量仪, 也有用半导体剂量仪的。热释光剂量仪在体内剂量测量时比半导体剂量仪更简单、更准确, 因而应用较多。Hood等[3]用小型的热释光剂量棒Pin worm (直径0.6 mm、长2 mm), 放在空心针和软施源管中, 在组织等效体模内测量192Ir插植剂量分布, Pin worm重复性小于2%、剂量测量下限为10 mGy。所测相对剂量分布与用ADAC公司生产的Pinnacle计划系统的计算值符合得很好。
测量值与TPS计算值间误差来源, TPS基于均匀水体模测量值进行计算, 计算值与电离室在水模体中的测量值相对误差小于±1 %, 仿真盆腔体模由非均匀的肌肉和骨等效材料组成, 其吸收剂量的差异是误差的主要来源之一; 误差还产生于剂量梯度的影响、测量位置空间几何重建误差、测量点远超出剂量计算参考距离(剂量计算公式的有效范围)、LiF与骨密度的差异、TLD测量本身固有的统计涨落。在2 cm处测线性、重复性、刻度的原因:一方面因A点距施源器距离为2 cm; 在距源小于2 cm的距离内, 剂量梯度大, 几何误差所致剂量差异大; 当距离过远时, 剂量率低, 达到一定剂量的照射时间长, 工作效率低。对于重建精度对结果的影响, Pantelis等[4]的研究表明, 1 mm施源器重建误差和沿施源器方向1.5mm的源驻留位置误差, 导致在小于2倍处方剂量的范围内, 剂量不确定度小于2%, 在靠近施源器表面的最大剂量不确定度可达5%。当重建误差为2 mm时, 在处方剂量1.5倍的剂量曲线范围内, 剂量的不确定度最高可达9%。
宫颈癌腔内后装治疗均为多分次的治疗, 每次治疗时插管难以保持一致, 计划设计时施源器的位置与治疗时的位置也会因病人的移动而变化, 这使计算剂量不能真实反映受照剂量。据Garipagaoglu等[5]报道施源器位置变化在3.2~12.1 mm, 直肠和膀胱参考剂量单次变化分别为64 ~75 cGy和47~58 cGy, 因此, 宫颈癌腔内后装治疗时固定施源器、尽可能减少病人移动具有重要意义。
Anagnostopulos等[6]报道用TLD-100热释光剂量棒放入4F塑料管中, 再置入6F插植针内, 插于尿道附近进行体内测量监测, 将测量结果与基于CT的三维计划系统的计算值进行比较, 单次偏差8.57 %±2.61%, 总平均偏差6.88%±4.93%。在体内剂量测试与远期并发症相互关系的研究中, Huh等[7]发现直肠出血与否, 患者直肠剂量参考点的计算值无差异, 但TLD测试值差异有显著性, 用微型热释光片(棒)进行体内剂量测试对预测直肠并发症具有指导意义。
在等效体模中一次性获取大量重要器官组织的受照剂量, 为体内剂量测量作了有益的探讨, 微型TLD可直接放入施源器中进行宫腔内、直肠、膀胱内或通过用插植针对其他组织器官进行体内剂量监测, 从实验结果来看, TLD实测剂量能较好地反映病人受照剂量, 预测放疗副作用、优化放疗计划, 提高疗效, 具有重要价值。
| [1] |
殷蔚伯, 谷铣之. 肿瘤放射治疗学[M]. 北京: 中国协和医科大学出版社, 2003: 902-922.
|
| [2] |
陈昆田, 何智纯, 曹新平. 近距离放射治疗宫颈癌(Ⅱ、Ⅲ)期的远期疗效[J]. 中华放射肿瘤学杂志, 1996, 5(12): 237-239. |
| [3] |
Hood C, Duggan L, Bazley S, et al. LiF:Mg, Cu, P ' pin worms' : miniature detectors for brachytherapy dosimetry[J]. Radiat Prot Dosimetry, 2002, 101(1-4): 407-410. |
| [4] |
Pantelis E, Papagiannis P, Anagnostopoulos G, et al. Evaluation of a TG-43 compliant analytical dosimetry model in clinical 192Ir HDR brachytherapy treatment planning and assessment of the significance of source position and catheter reconstruction uncertainties[J]. Phys Med Biol, 2004, 49(1): 55-67. DOI:10.1088/0031-9155/49/1/004 |
| [5] |
Garipagaoglu M, Tuncel N, Koseoglu FG, et al. Geometric and dosimetric variations of ICRU bladder and rectum reference points in vaginal cuff brachytherapy using ovoids[J]. Int J Radiat Oncol Biol Phys, 2004, 58(5): 1607-1615. DOI:10.1016/j.ijrobp.2003.11.039 |
| [6] |
Anagnostopoulos G, Baltas D, Geretschlaeger A, et al.In vivo thermoluminescence dosimetry dose verification of transperineal 192Ir high-dose-rate brachytherapy using CT-based planning for the treatment of prostate cancer[J]. Int J Radiat Oncol Biol Phys. 2003 Nov 15; 57(4): 1183-1191.
|
| [7] |
Huh SJ, Lim do H, Ahn YC, et al. Comparison between in vivo dosimetry and barium contrast technique for prediction of rectal complications in high-dose-rate intracavitary radiotherapy in cervix cancer patients[J]. Strahlenther Onkol, 2003, 179(3): 191-196. DOI:10.1007/s00066-003-1015-2 |