放射性肺炎(radiation-induced pneumonitis, RP)是非小细胞肺癌(non-small cell lung cancer, NSCLC)放射治疗常见并发症, 其发生率为13 %~37%[1, 2], 而发生亚临床功能和影像学改变的比例更高[3]。RP的发生率及严重程度随着正常肺组织受照剂量的增加而提高[4], 这是常规放疗难以提高照射剂量的重要原因。三维适形放疗(3-dimentional conformal radiotherapy, 3D-CRT)被认为是提高NSCLC照射剂量的重要途径, 而3DCRT的关键步骤是靶区的勾画。通常情况下, 靶区勾画是以CT为基础的, 但CT勾画靶区的准确性受到限制[5]。正电子发射型计算机断层扫描(positron emission tomography, PET)作为一种功能影像可以提供更加准确的有关NSCLC原发肿瘤和转移淋巴结的靶区信息, 而PET/CT实现了PET和CT的同机融合, 进一步提高了NSCLC分期和3D-CRT靶区勾画的准确性[6]。笔者试就PET/CT对NSCLC分期的敏感性、准确性进行探讨, 并通过对剂量体积直方图(dose volume histogram, DVH)相关参数的分析预测RP的发生率。2002年10月~2004年6月, 共对34例患者进行了分析研究, 现将结果报告如下。
1 材料与方法 1.1 临床资料34例患者中男28例, 女6例。年龄34~83岁, 中位65.2岁。所有患者均取得病理学或细胞学诊断, 鳞癌19例, 腺癌14例, 腺鳞癌1例。
1.2 病例入组标准① 拟行手术治疗或3D-CRT根治性放疗者。②有CT及PET可见病灶。③经细胞学或病理学证实为NSCLC。④患者本人同意。入组病例中有30例于PET/CT检查后行手术治疗, 其TNM分期也因此进一步得到了病理学证实。
1.3 扫描设备与计划系统GE Discovery LS型PET/CT、Minitrace回旋加速器、Tracerlab FDG合成模块、Fusion 1.0.43图像融合软件和Topslane治疗计划系统。
1.4 PET/CT扫描方法检查前患者空腹6 h以上, 测定血糖在正常范围后经肘静脉注射显像剂(18F-FDG, 5.55~7.40 MBq/kg), 平静休息45 min后仰卧于碳纤维3D-CRT定位床上并负压袋体位固定, 激光灯定位并在胸部正中线及身体两侧放置金属标记(标记点尽量靠近病灶)。在平静呼吸下先行CT定位扫描, 随后对相同范围进行PET图像采集, 并用CT数据进行PET图像的衰减校正。扫描结束后用迭代法重建图像, 行多层面显像, 将CT、PET、PET/CT数据分别传输至Topslane TPS工作站。
1.5 靶区勾画分别利用横断轴位CT图像、PET/CT融合图像进行靶区勾画, 需除外可疑肺不张、胸膜渗出、血管结构、肺炎等区域, 任何最小截面直径≥1 cm的淋巴结也予以勾画。在PET/CT图像上勾画肉眼靶区(GTV)时, 以病灶处最大标准摄取值(SUV)为100%, 选取45%水平定为肿瘤边界。如果两个或更多病灶距离1 cm以上, 则分别进行勾画并计算总体积。
1.6 计划制定与实施依据1997年WHO肺癌分期标准分别进行CT分期和PET/CT分期, 比较PET/CT检查前后对肺癌TNM分期的影响。再分别以CT图像和PET/CT融合图像在Topslane软件上以相同参数[原发灶GTV外放15 mm作为计划靶区1(PTV1), 转移淋巴结GTV外放7 mm作为PTV2。选择标记点所在平面为等中心平面, DT 200 cGy次, 共30次, 射野数相同, Gantry角及多叶光栅设置依具体情况做适当调整, 90%等剂量线包绕PTV]制定放疗计划, 按临床要求评价计划的优劣, 不符合要求者需重新优化设计直至满意。放疗时采取同样体位, 严格对照标记点, 首次放疗时需有放疗科医师摆位, 观察患者体位、标记点符合程度、移床和升床距离以及各照射野的位置和大小。前三次放疗以电子射野影像系统(electronic portal imaging device, EPID)进行验证。有手术指征者则手术治疗。
1.7 参数评估选择PTV体积(VPTV=VPTV1+VPTV2)、受照量≥ 20 Gy的肺体积占全肺总体积的比例(V20)、平均全肺受照射剂量(MLD)、肿瘤控制概率(TCP)、正常组织并发症概率(NTCP)、脊髓受照射剂量(Ds)等指标对两种治疗计划进行对比分析。
1.8 统计分析用SPSS11.0软件对VPTV、V20、MLD、Ds、TCP、NTCP进行配对t检验。
2 结果 2.1 对TNM分期及治疗计划的影响PET/CT检查前后肺癌TNM分期改变者13例, 占38.2%。其中分期升高者8例, 下降者5例, 10例(29.4%)治疗计划因而发生改变。PET/CT检查前拟行手术治疗的20例中, 于检查后无法手术而改为根治性放疗者5例, 另外2例因发现远处转移灶而改为姑息性放疗。检查后由根治性放疗而改为手术者3例, 另1例因发现同侧肺内不同肺叶的转移灶而改为姑息性放疗。
2.2 与术后病理结果的对比16例手术患者中, 术后病理检查结果与PET/CT分期一致者14例。1例术后病理诊断为N1, 但PET/CT诊断为N0, 为假阴性; 另1例术后病理诊断为N0, 但PET/CT诊断为N1, 为假阳性。PET/CT诊断的敏感性为93.3 %, 准确性为87.5 %。
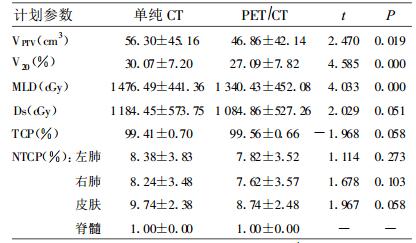
2.3 两组间评估参数的统计学分析依PET/CT制定计划者VPTV为(46.86 ±42.14)cm3, 而依CT制定计划者为(56.3 ± 45.16)cm3, 两者差异有显著性(P=0.019), 后者高于前者; 两组V20分别为(27.09±7.82)%和(30.07±7.20)%, 两者差异有显著性(P=0.000), 后者高于前者。两组MLD分别为(1 340.43 ±452.08)cGy和(1 476.49 ±441.36)cGy, 两者差异有显著性(P=0.019), 后者高于前者。两组的NTCP分别为左肺(7.82±3.52)%和(8.38 ±3.83)%和右肺(7.62±3.57)%和(8.24±3.48)%, PET/CT组低于CT组, 但差异无显著性(P > 0.05)。两组参数对比详见表 1。
|
|
表 1 两种放疗计划若干参数的比较 |
PTVPET/CT >PTVCT者10例, 多是由于PET/CT检测纵隔淋巴结转移的敏感性较CT高, 能检测出尚不符合CT诊断标准(短径≥1 cm)的转移淋巴结, 从而使靶区有所增大。PTVPET/CT < PTV CT者24例, 主要是由于PET/CT可鉴别出在CT图像上容易与肿瘤相混淆的肺不张和阻塞性肺炎。
3 讨论放射线对肺组织的损伤受很多因素的影响, 是一个非常复杂的问题。常规放疗时, 常用照射野大小、单次分割剂量和总照射剂量等作为评价RP的物理参数, 在3D-CRT时, 其DVH中的V20、MLD、TCP、NTCP等则成为预测和评价RP的重要物理变量[7, 8]。Graham等[9]对99例NSCLC的V20、MLD、肺有效容积(Veff)、肿瘤位置等参数进行了前瞻性研究, 单因素分析显示MLD与RP明显相关(P=0.016), MLD < 20 Gy时RP发生率为8%, 而>20 Gy时高达24%。多因素分析表明, V20是唯一有价值的、与≥Ⅱ级RP的发生有明显相关性的预测因子。V20不仅与RP的发生率呈正相关, 而且与其严重程度明显相关, V20 < 20%时, 无RP发生; 22%~31 %时, 8%的患者发生Ⅱ级RP, 无Ⅲ级以上者; ≥32%时才发生了Ⅲ级以上的RP; >40 %时Ⅲ ~ Ⅳ级RP发生率为23%。NTCP经验模式可以相对全面地体现DVH的整体信息, 但计算复杂, 求出的值也并非临床并发症概率的绝对值, 所以一般用计算相对简单的Veff代表RP的相对概率。临床资料显示, Veff < 0.23时, Ⅱ级RP发生率为6%, > 0.23时为27%(P=0.003) [10]。
除照射剂量和体积等物理因素外, 放射性肺损伤还与不同个体的基础肺功能及放射敏感性等生物学因素有关。Marks等[10]认为, 如果将DVH和生物学因素结合起来, 以功能性DVH(fDVH)评价放射性肺损伤, 其结果将会更可靠。Fu等[1]则认为TGF-β结合V30可更好地预测RP。可以预见, 在现有的NTCP模式中融入功能影像(如SPECT、PET)和生物学因子(如TGF-β等)将更有助于提高预测结果的可靠性。
RP的发生与照射容积密切相关, 因此, NSCLC放疗靶区的精确勾画是减少RP的关键, 尤其是在3D-CRT中, 靶区勾画是最基础、最关键的一环, 靶区勾画的精确与否直接影响后续过程的进行及质量。有资料表明, 靶区勾画错误是整个放疗环节中最严重的错误[11], 即使在容易勾画靶区的周围型T1N0M0的患者, Senan等[12]发现6位放疗科医师对3名患者的GTV勾画也存在很大差异, 最大与最小体积之比为1.6, 而且这种差异随着临床分期的提高而增大, 甚至达到超过2倍的程度。我们的研究结果也证实了这一点, 由表 1可见, 根据CT图像所做的3D-CRT计划的VPTV明显大于根据PET/CT图像者(P=0.019), 主要是由于本组中有5例(14.7%)合并肺不张、阻塞性肺炎, 在勾画靶区时二者之间的差别较大所引起的。由于VPTV之间的明显差别, 导致V20、MLD在两种计划之间也出现明显的差别, 但TCP、NTCP的差别并不明显。这说明, 在靶区勾画时, 对于合并肺不张、阻塞性肺炎者尤其应注意, 应尽量行PET/CT检查, 根据PET/CT检查结果进行靶区勾画的可靠性更大, 临床意义更强。
肺不张、胸膜粘连或阻塞性肺炎的存在是导致靶区勾画差异的主要原因, 目前有两种做法:①把上述正常组织包括在GTV内, 使照射体积增大, 但这样势必会增加放射损伤, 应避免; ②尽量鉴别出肿瘤与肺不张组织, 以单独勾画肿瘤组织为GTV, 但这需要高分辨率的CT图像、对比造影剂的快速体内注入及图像的快速采集, 即便如此, 仍不能完全满足临床要求。
PET作为一种先进的功能影像技术, 在显示原发灶和转移灶方面比CT具有更高的敏感性、特异性和准确性, 分别达到76 %~92%、81 %~100 %和80%~100%, 而CT分别只有56 %~65%、73 %~87 %和77%~82%[13]。PET/CT融合扫描系统能在精细的解剖层面上显示局部的组织功能, 因而能更准确地提供原发灶、区域转移淋巴结及远处转移灶的解剖和功能信息, 进一步提高了诊断的敏感性、特异性和准确性[14~17]。对于伴发阻塞性肺炎、肺不张、胸膜受侵和胸腔积液, CT确定肿瘤边界有困难者, PET/CT尤其能显出优势。另一方面, PET/CT既能检出在CT上看来是正常大小的转移淋巴结, 从而避免靶区遗漏, 也能排除CT诊断为转移的、因其它原因而导致增大的淋巴结, 从而可缩小照射体积, 为提高照射剂量赢得更大空间, 并能有效地减小周围正常组织的受照射体积, 因而可明显降低RP的发生率和严重程度[18, 19]。我们的研究结果表明, PET/CT图像融合可在保证Ds、TCP、NTCP符合临床要求的前提下明显减小VPTV(P=0.019), 进而明显降低V20(P=0.000)和MLD(P=0.000), 因此, 根据PET/CT勾画的3D-CRT靶区更精确, 对周围正常组织保护得更好。
由于PET/CT可除外那些有远处转移或广泛纵隔淋巴结侵犯的病例, 故可更严谨地筛选病人、更严格地执行根治性放疗的指征, 同时由于根据PET/CT而勾画的靶区更精确, 对周围正常组织保护得更好, 所以可降低早期病因死亡率, 这已由Mac Manus的研究结果所证实[20]。本研究中根治性放疗病例的RP实际发生率和病因死亡率正在随访中。
| [1] |
Fu XL, Huang H, Bentel G, et al. Predicting the risk of symptomatic radiation-induced lung injury using the physical and biologic parameters V30 and TGF-β[J]. Int J Radiat Oncol Biol Phys, 2001, 50(4): 899-908. DOI:10.1016/S0360-3016(01)01524-3 |
| [2] |
Hernando ML, Marks LB, Bentel GC, et al. Radiation induced pulmonary toxicity: A dose-volume histogram analysis in 201 patients with lung cancer[J]. Int J Radiat Oncol Biol Phys, 2001, 51(3): 650-659. DOI:10.1016/S0360-3016(01)01685-6 |
| [3] |
Abratt RP, Morgan GW. Lung toxicity following chest irradiation in patients with lung cancer[J]. Lung Cancer, 2002, 35(2): 199-203. |
| [4] |
Claude L, Pérol D, Ginestet C, et al. A prospective study on radiation pneumonitis following conformal radiation therapy in nonsmall cell lung cancer:Clinical and dosimetric factors analysis[J]. Radiother Oncol, 2004, 71(2): 175-181. |
| [5] |
Chapman JD, Bradley JD, Eary JF, et al. Molecular (functional) imaging for radiotherapy applications:An RTOG symposium[J]. Int J Radiat Oncol Biol Phys, 2003, 55(2): 294-301. DOI:10.1016/S0360-3016(02)04215-3 |
| [6] |
Ling CC, Humm J, Larson S, et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and conformality[J]. Int J Radiat Oncol Biol Phys, 2000, 47(3): 551-560. DOI:10.1016/S0360-3016(00)00467-3 |
| [7] |
Vujaskovic Z, Marks LB, Anscher MS. The physical parameters and molecular events associated with radiation-induced lung toxicity[J]. Semin Radiat Oncol, 2000, 10(4): 296-307. |
| [8] |
Kwa SL, Theuws JC, Wagenaar A, et al. Evaluation of two dose volume histogram reduction models for the prediction of radiation pneumonitis[J]. Radiother Oncol, 1998, 48(1): 61-69. |
| [9] |
Graham MV, Purdy JA, Emami B, et al. Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for nonsmall cell lung cancer (NSCLC)[J]. Int J Radiat Oncol Biol Phys, 1999, 45(2): 323-329. DOI:10.1016/S0360-3016(99)00183-2 |
| [10] |
Marks LB, Spencer DP, Sherouse GW, et al. The role of three dimensional functional lung in radiation treatment planning: The functional dose-volume histogram[J]. Int J Radiat Oncol Biol Phys, 1995, 33(1): 65-75. DOI:10.1016/0360-3016(95)00091-C |
| [11] |
Rasch C, Barillot I, Remeijer P, et al. Definition of the prostate in CT and M RI: A multi-observer study[J]. Int J Radiat Biol Phys, 1998, 43(1): 57-66. |
| [12] |
Senan S, van Sornsen de Koste J, Samson M, et al. Evaluation of a target contouring protocol for 3D conformal radiotherapy in non-small cell lung cancer[J]. Radiother Oncol, 1999, 53(2): 247-255. |
| [13] |
Sasaki M, Ichiya Y, Kuwabara Y, et al. The usefulness of FDG positron emission tomography for the detection of mediastinal lym ph node metastases in patients with non-small cell lung cancer: A comparative study with X-ray computed tomography[J]. Eur J Nucl Med, 2003, 23(7): 741-747. |
| [14] |
Schmid RA, Hautmann H, Poellinger B, et al. Staging of recurrent and advanced lung cancer with 18F-FDG PET in a coincidence technique (hybrid PET)[J]. Nucl Med Comm, 2003, 24(1): 37-45. |
| [15] |
Dwamena BA, Sonnad SS, Angobaldo JO, et al. Metastases from non-small cell lung cancer:Mediastinal staging in the 1990s-meta-analytic comparison of PET and CT[J]. Radiology, 1999, 213(2): 530-536. |
| [16] |
Gupta NC, Tamin WJ, Graeber GG, et al. Mediastinal lymph node sampling following positron emission tomography with fluorodeoxyglucose imaging in lung cancer staging[J]. Chest, 2001, 120(2): 521-527. DOI:10.1378/chest.120.2.521 |
| [17] |
Maier AG, Kersting-Sommerhoff B, Reeders JW, et al. Staging of rectal cancer by double-contrast MR imaging using the rectally administered superparamagnetic iron oxide contrast agent ferristene and Ⅳ gadodiamide injection:Results of a multicenter phase Ⅱ trial[J]. J Magn Reson Imaging, 2000, 12(5): 651-660. |
| [18] |
Giraud P, Grahek D, Montravers F, et al. CT and 18F-deoxyglucose(FDG) image fusion for optimizations of conformal radiotherapy of lung cancers[J]. Int J Radiat Oncol Biol Phys, 2001, 49(5): 1249-1257. DOI:10.1016/S0360-3016(00)01579-0 |
| [19] |
Erdi YE, Rosenzweig K, Erdi AK, et al. Radiotherapy treatment planning for patients with non-small cell lung cancer using positron emission tomography (PET)[J]. Radiother Oncol, 2002, 62(1): 51-60. |
| [20] |
Mac Manus MP, Wong K, Hicks RJ, et al. Early mortality after radical radiotherapy for non-small cell lung cancer: comparison of PET-staged and conventionally staged cohorts treated at a large tertiary referral center[J]. Int J Radiat Oncol Biol Phys, 2002, 52(2): 351-361. DOI:10.1016/S0360-3016(01)02673-6 |