2. 酶工程教育部重点实验室, 吉林 长春 130021
我们以往采用原位末端标记(TUNEL)和常规HE染色实验研究发现, 低剂量电离辐射可以诱导小鼠睾丸生精细胞凋亡的适应性反应[1]。笔者采用流式细胞术(FCM)进一步观察了低剂量X射线照射诱导小鼠生精细胞凋亡适应性反应的变化规律, 同时采用免疫组化法观察p53蛋白表达的变化, 为探讨低剂量辐射诱导细胞遗传学适应性反应的机理提供有意义的实验依据。
1 材料和方法 1.1 动物及照射采用雄性健康昆明小鼠, 体重(20 ± 2) g, 由本校实验动物中心提供。动物随机分为假照组、D2照射组和D1+D2实验组, 每组8只。用国产深部X射线治疗机全身照射小鼠, 电压200 kV, 电流10 mA, 滤板0.5 mm Cu+1.0 mm Al。分别观察诱导剂量照射(D1, 75 mGy :靶皮距212 cm, 剂量率12.5 mGy/min) 3、6、12和24 h后接受不同攻击剂量照射(D2, 1.0、2.0和3.0 Gy :靶皮距50 cm, 剂量率287 mGy/min)的凋亡细胞百分率的变化。
1.2 睾丸细胞悬液制备参照文献[2, 3], 并作适当改动。待D2照后12 h, 小鼠断头, 立即取出睾丸置于冰冷的细胞悬浮液(含5 mmol EDTA及0.1 %葡萄糖的PBS液)中, 漂洗, 称重, 在无菌情况下制备细胞悬液(每4个睾丸合为1个样品), 按1 g组织20 ml溶液之比例加入预冷的细胞悬浮液。搅拌(120 r/min, 室温, 10 min), 加入胰蛋白酶液(终浓度0.02 mg/ml), 搅拌10 min; 加RNase Ⅱ溶液(终浓度0.02 mg/ml), 搅拌15 min; 加BSA(终浓度5 mg/ml), 搅拌均匀后用1 200目纱网过滤2次, 计1×107细胞ml, 备检。
1.3 生精细胞分离参照文献[2, 3], 并作适当改进。60 %泛影葡胺经低密度溶液(NaCl 8.6 mg、KCl 0.3 mg、CaCl2·2 H2O 0.37 mg、BSA 500 mg和RNase Ⅱ100 mg于1 000 ml双蒸水中)不同比例稀释混匀, 其密度分别为1.06、1.08、1.10和1.12的泛影葡胺溶液。在10 ml玻璃离心管中, 用6号封闭针分别吸取密度为1.12、1.10、1.08及1.06的溶液各1.5 ml, 按密度从大到小的顺序仔细铺好密度梯度溶液(不得搅混液面)。将1 ml需要分离的睾丸细胞悬液(约1×107细胞)轻轻铺于梯度溶液顶上, 离心(4 000 r/min, 4 ℃, 30 min)。离心后可见溶液不同密度的5层细胞, 即由上到下为精原细胞(第1层)、精母细胞(第2层)、精子细胞和精子(第3和4层)和细胞碎片及红细胞等(第5层), 分别用吸管吸出并收集。各类生精细胞悬液分别离心(3 000 r/min, 4 ℃, 20 min), 弃上清, PBS洗2次, 离心(800 r/min, 4 ℃, 5 min), 弃上清。以每份样品3×106细胞固定于70 %冷乙醇中, 4 ℃保存, 备检。
1.4 生精细胞凋亡检测[4]取待测生精细胞样品分别用0.01 mol L PBS洗2次, 离心(1 500 r/min, 4 ℃, 5 min), 弃上清, 加0.01 % RNase溶液200 μl和碘化丙啶(PI)染液(0.05 g L, 含0.03 % Trinton X-100) 0.5 ml, 4 ℃避光30 min后, 用美国B-D公司FACScan流式细胞仪检测。采用CellQuesl软件收集细胞(每份样品收取10 000个细胞), 用ModiFit软件分析细胞凋亡, 记录Ap亚峰细胞凋亡百分率。
1.5 组织标本制备小鼠照射后, 在不同时间点分别处死, 迅速取其睾丸, 4 %多聚甲醛固定, 24 h后系列酒精脱水, 二甲苯透明, 石蜡包埋, 切成5 μm厚切片, 粘于APES+多聚赖氨酸处理的载玻片上, 60 ℃烤干2 h, 备用。
1.6 p53蛋白检测采用免疫组化法检测p53蛋白表达。将切片常规系列酒精下行入水, 在盛有枸橼酸-枸橼酸钠溶液的容器中浸泡, 加热92~98 ℃, 10 min。取出后室温冷却10 min, PBS洗后山羊血清封闭20 min, 加小鼠抗p53蛋白单克隆抗体, 4 ℃过夜。PBS洗后加生物素化羊抗兔IgG, 37 ℃反应60 min, PBS洗后加SABC复合液, 37 ℃反应60 min, PBS洗后DAB显色, 脱水透明封片, 图像分析。阴性对照组PBS液取代p53蛋白抗体。p53阳性细胞核呈棕黄色, 仅显示细胞轮廓者为阴性细胞。
1.7 统计学处理采用CMIAS-007全新型多功能真彩色病理图像分析系统对免疫组化结果进行定量分析, 每一切片中观察并计算不同种类生精细胞各500个p53蛋白表达阳性的细胞数, 求得阳性百分率。实验结果用x±s表示, 采用t检验进行统计学分析。
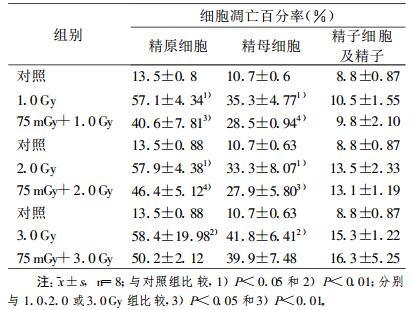
2 结果(1) 75 mGy(D1)全身照射小鼠后6 h, 再接受1.0、2.0或3.0 Gy(D2)照射, 12 h后处死。FCM检测发现, D2组精原细胞和精母细胞凋亡百分率明显高于假照组(P < 0.05或P < 0.01)。虽然D1+D2组精原细胞和精母细胞凋亡百分率也高于假照组, 但却明显低于D2组(P < 0.05或P < 0.01)。各剂量点精子细胞及精子凋亡无明显差异(表 1)。
|
|
表 1 大剂量照射前6 h给予75 mGy预照射诱导的小鼠睾丸生精细胞凋亡 |
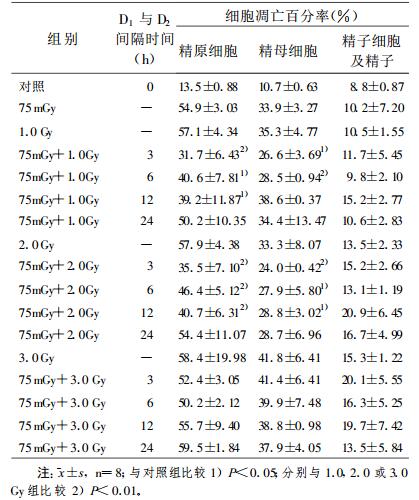
(2) 75 mGy(D1)全身照射小鼠后3、6、12或24 h, 给予1.0、2.0或3.0 Gy的D2全身照射, FCM检测发现1.0 Gy照射后3和6 h精原细胞和精母细胞凋亡百分率即明显低于单纯D2照射组(P < 0.05或P < 0.01), 一直持续到12 h(P < 0.05); 2.0 Gy照射后3和6 h精原细胞和精母细胞凋亡也明显低于单纯D2照射组(P < 0.05或P < 0.01), 持续到12 h (P < 0.01); 3.0 Gy D2照射后6 h精原细胞凋亡低于单纯D2照射组(P < 0.1), 其他时间点变化无显著性差异。各剂量点和各时间点精子细胞及精子凋亡无明显差异(表 2)。
|
|
表 2 大剂量照射前不同时间给予75 mGy预照射诱导的小鼠睾丸生精细胞凋亡 |
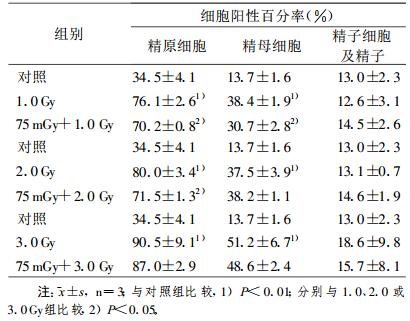
(3) 在D1照射后6 h, 小鼠接受D2照射, 12 h后发现D2组精原细胞和精母细胞p53蛋白细胞阳性率明显高于假照组(P < 0.01);虽然D1+D2组精原细胞和精母细胞p53蛋白表达也高于假照组, 但却明显低于D2组(P < 0.05);各剂量点精子细胞和精子p53蛋白表达无明显差异(表 3)。
|
|
表 3 大剂量照射前6 h给予75 mGy预照射诱导小鼠睾丸生精细胞的p53蛋白表达 |
我们继用TUNEL和HE染色形态学方法证实低剂量辐射可诱导小鼠睾丸生精细胞凋亡适应性反应以后[1], 又通过FCM进一步证实, 低剂量X射线照射可选择性诱导小鼠生精细胞凋亡的适应性反应。实验结果表明, 1.0、2.0和3.0 Gy D2剂量照射小鼠前给予75 mGy D1预照射, 可以明显减轻D2照射对精原细胞和精母细胞的凋亡作用, 对精子细胞及精子影响不明显。低剂量预照射可以明显降低后来大剂量照射所造成的细胞凋亡, 从而起到保护作用, 并且具有细胞种类规律性, 即精原细胞和精母细胞凋亡百分率下降, 而精子细胞和精子表现不明显。
据文献报道[4], 在精子发生中存在生精细胞自发凋亡现象, 其中主要是精原细胞和精母细胞, 而且精原细胞凋亡率大于精母细胞, 很少发生在精子细胞中。精原细胞凋亡均发生在有丝分裂期间; 精母细胞除高发于减数分裂期间(在小鼠生精周期Ⅸ阶段)外, 细线期、偶线期, 尤其是粗线期精母细胞也常发生凋亡。已知减数分裂前期时间较长, 有许多重要的生物学事件发生, 因此这一期间出现自发的有细胞种类规律性的生精细胞凋亡, 以淘汰在DNA合成及同源染色体交换遗传物质过程中出现差错的细胞, 具有重要的遗传学意义。这与本实验中75 mGy预照射诱导生精细胞凋亡的保护性效应具有细胞种类规律性的结果相吻合。目前, 大量研究表明, 在大剂量照射前接受几mGy和几十mGy的单次照射可减少单次1~3 Gy低LET辐射在增殖的哺乳动物细胞中诱发的染色体畸变和突变数[5]。而且, 机体在进化发育过程中获得了各种保护性机制, 以修复和调节在生理条件下不断产生的DNA损伤。比本底辐射高出多倍的剂量并不使DNA损伤显著增多, 却能刺激氧化性DNA损伤的修复, 不能修复则可能以细胞凋亡形式清除。75 mGy照射是在增强机体生精细胞修复过程的同时, 也明显选择性增加精原细胞和精母细胞凋亡率, 有效清除大剂量照射所致遗传损伤的生精细胞, 使这两类细胞表现出明显的适应性反应, 降低子代畸形率和显性致死效应。这为低剂量辐射诱导细胞遗传学适应性反应的机制提供了重要的实验依据。
同时, 本实验中采用D1照射后不同时间间隔进行不同D2剂量全身照射, 发现选择性诱导生精细胞凋亡适应性反应的规律与D1与D2间隔时间及D2剂量有关。通常在D1照射后6 h进行D2照射可以诱导出现适应性反应。其结果同我室前期研究低剂量辐射诱导免疫适应性反应[6~9]和细胞遗传适应性反应[10, 11]实验结果相符。在不同实验中所获适应性反应的规律基本一致, 说明D1和D2只有间隔一定时间, D2在一定剂量范围内才能诱导适应性反应。但是, 在研究低剂量辐射诱导适应性反应的剂量效应时, 也应考虑射线种类、剂量率、D1剂量范围、不同生物的个体差异及外界环境因素影响等。
另外文献表明[12], 在p53基因敲除的小鼠细胞和具有功能缺失p53基因的PSV永生化AT细胞, 低剂量辐射不能诱导适应性反应发生。Yang等人[13]也观察到, 由于Trp53基因转录水平通过甲基化修饰使其功能失活的m5S细胞也不能诱导适应性反应发生。进一步的研究认为, p53基因在低剂量辐射适应性反应中起关键性作用。由于电离辐射致畸、致突变等损害效应常是由于DNA双链断裂(DSB)所致。在真核细胞中, DSB调节途径是复杂的, 可能通过细胞周期检查点调控诱导细胞周期阻滞, 促进损伤的DNA修复, 不能修复则通过细胞凋亡形式清除损伤细胞, p53基因在所有上述环节中均发挥关键性的调节作用, 以保持基因组完整性[14]。而且, 近来已有实验证明[15], p53基因有可能是通过PKC-p38MAPK-PLC环路相互作用, 激活DNA损伤修复机制诱导低剂量辐射适应性反应发生。为进一步探讨其分子调控机制, 本实验采用免疫组化法定量地观察了75 mGy照射诱导小鼠生精细胞p53蛋白表达的适应性反应。结果表明, 当1.0、2.0或3.0 Gy(攻击剂量, D2)照射前6 h给予D1预照射, 精原细胞和精母细胞p53蛋白表达明显减少, 而对精子细胞和精子影响不明显。这不但进一步证明p53基因在低剂量辐射诱导适应性反应中起重要的调控作用, 而且与其选择性诱导生精细胞凋亡的适应性反应结果一致, 即1.0、2.0和3.0Gy D2剂量照射前6 h给予75 mGy预照射, 可以明显减轻D2照射对精原细胞和精母细胞的凋亡损伤作用, 对精子细胞和精子影响不明显, 从而为其提供分子水平证据。上述结果提示, 低剂量辐射选择性诱导生精细胞凋亡有可能通过p53基因选择性上调表达实现的, 从而进一步为其诱导适应性反应凋亡机制的研究提供了更深层次的实验证据。
| [1] |
刘光伟, 李鹏武, 刘淑春, 等. 低剂量电离辐射诱导小鼠睾丸生精细胞凋亡的适应性反应[J]. 中华放射医学与防护杂志, 2002, 23(5): 322-325. DOI:10.3760/cma.j.issn.0254-5098.2002.05.004 |
| [2] |
黄均蓉, 李征明. 不连续密度梯度离心法分离睾丸细胞[J]. 生殖与避孕, 1980, 13(1): 53-59. |
| [3] |
吴鲣, 蒋耀青. Percoll密度梯度离心分离不同发育阶段生精细胞的方法[J]. 遗传, 1987, 9(6): 33-35. |
| [4] |
龚守良, 刘树铮. 生精细胞凋亡与电离辐射[J]. 国外医学·放射医学核医学分册, 1999, 23(5): 227-230. |
| [5] |
刘树铮. 低剂量辐射兴奋效应发生机理若干问题的探讨[J]. 中华放射医学与防护杂志, 2003, 23(6): 393-398. DOI:10.3760/cma.j.issn.0254-5098.2003.06.001 |
| [6] |
Gong SL, Liu SC, Liu JX, et al. Adaptive response of thymocyte apoptosis and cell cycle progression induced by low dose X-ray irradiation in mice[J]. Biomed Environ Sci, 2000, 10: 248-255. |
| [7] |
鞠桂芝, 苏旭, 傅海青, 等. 低剂量辐射诱导免疫适应性反应的研究[J]. 中华放射医学与防护杂志, 1999, 19(6): 369-371. DOI:10.3760/cma.j.issn.0254-5098.1999.06.002 |
| [8] |
Chen SL, Cai L, Meng QY, et al. Low dose wholebody irradiation (LD-WBI) changes protein expression of mouse thymocytes: effect of a LD-WBI-enhanced protein RIP 10 on cell proliferation and spontaneous or radiation induced thymocyte apoptosis[J]. Toxicol Sci, 2000, 55(2): 97-106. |
| [9] |
赵勇, 龚守良, 刘树铮. 低剂量电离辐射对免疫器官局部微环境的免疫调节作用[J]. 中国病理生理杂志, 1998, 14(2): 1-4. |
| [10] |
蔡露. 低水平辐射诱导的细胞遗传学适应性反应[J]. 遗传学报, 1991, 18(3): 109-114. |
| [11] |
Cai L, Liu SZ. Induction of an adaptive response to dominant lethality and to dominant lethality and to chromosome damage of mouse germ cells by low dose radiation[J]. Mutat Res, 1993, 303(1): 157-159. |
| [12] |
Sasaki MS. On the reaction kinetics of the radioadaptive response in cultured mouse cells[J]. Int J Radiat Biol, 1995, 68(2): 281-291. |
| [13] |
Yang L, Sasaki MS. Trans-regulated silencing and reaction of Trp53 tumor suppressor gene in malignant transformation and its reversiong[J]. J Cancer Res, 2000, 91(13): 1111-1118. |
| [14] |
Pfeiffer P, Goedecke W, Obe G. Mechanisms of DNA doublestrand break repair and their potential to induce chromosomal aberration[J]. Mutagenesis, 2000, 15(3): 289-302. |
| [15] |
Sasaki MS, Ejima Y, Tachibana A, et al. DNA damage response pathway in radiaoadaptive response[J]. Mutat Res, 2002, 2504(2): 101-118. |