褪黑素(melatonin, MLT)是一种主要由松果腺分泌的吲哚类激素, 即N-乙酰基-5-甲氧基色胺。内源性MLT在机体多种生理功能中发挥重要作用。早在1981年Maestroni[1]就已发现, 功能性或药物性抑制MLT的生物合成均可导致小鼠体液和细胞免疫功能降低。目前, 越来越多的学者致力于MLT与免疫功能关系的研究。MLT可增强机体细胞免疫和体液免疫功能, 并促进免疫细胞分泌多种细胞因子, 还可对抗急性应激、病毒感染或预先使用糖皮质激素、环磷酰胺所致的免疫抑制状态, 拮抗各种外源性因素及内源性因素对免疫功能的损害作用, 不同程度地恢复机体的免疫功能。表明松果腺MLT可通过不同途径、对免疫系统的不同层次发挥调节作用。同时, 松果腺与免疫系统之间存在相互作用与相互影响的关系, MLT是机体神经内分泌-免疫网络的重要信息分子。免疫系统的辐射敏感性较高, MLT对大剂量电离辐射引起的免疫功能抑制是否也有拮抗作用引起了放射医学研究者的兴趣。近年来, 有研究者发现体内给予MLT可拮抗电离辐射损伤, 延长辐射后小鼠的存活时间[2], Vijayalaxmi等[3, 4]发现MLT对γ射线诱导的人外周血淋巴细胞染色体损伤有显著抑制作用, Koc等[5]发现MLT可以拮抗γ射线全身照射诱导的氧化损伤, Erol等[6]也报道MLT对γ射线诱导的脑氧化损伤有防护作用。这些报道均提示MLT可以减轻电离辐射损伤。笔者旨在进一步探讨MLT对小鼠淋巴细胞电离辐射损伤的影响并分析其可能的机制。
1 材料与方法 1.1 动物采用雄性昆明小鼠和C57BL/6J小鼠, 体质量(18±2)g, 在12 h:12 h光照与黑暗条件下饲养, 自由摄食、饮水, 保持室温20~25 ℃, 3 d后用于实验研究。
1.2 照射条件国产深部X射线治疗机, 管电压200 kV, 电流10 mA, 滤板0.5 mmCu +1.0 mmAl, 球靶距56 cm, 剂量率0.287 Gy/min。照射剂量为0~6.0Gy。
1.3 细胞悬液的制备断头处死小鼠, 无菌条件下取出胸腺和脾脏, 立即置于盛有RPMI 1 640培养基的平皿中, 用常规方法制成单细胞悬液。用Hank' s液洗涤细胞2次后, 将细胞重悬于含10%新生小牛血清的上述培养基中。用2%冰乙酸稀释, 显微镜下计细胞数, 调胸腺淋巴细胞浓度1×107/ml、脾淋巴细胞浓度5×106/ml, 备用。
1.4 淋巴细胞凋亡检测离体研究中, 取小鼠胸腺和脾淋巴细胞各1×107/孔, 加入24孔培养板, 再加入MLT, 使其终浓度为2 mmol/L, 对照组加等体积生理盐水, 置于37 ℃、5% CO2条件下培养, 2 h后给予不同剂量照射, 继续培养8 h, 检测细胞凋亡变化。整体研究中, 将小鼠随机分组后, 于晚19:00 h腹腔注射不同浓度MLT(对照组注射等体积生理盐水), 60 min后再给予2 Gy照射, 照后12 h检测胸腺和脾脏淋巴细胞凋亡的变化。
凋亡小体百分率采用流式细胞术(FCM)检测, 以Ap亚峰细胞的百分率记录数据。DNA裂解率测定采用荧光分光光度法, 提取与分离DNA断片和完整DNA后, 用DAPI对DNA进行荧光标记, LS 50 B荧光分光光度计测定荧光强度。其计算公式如下:
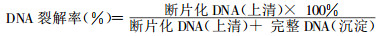
|
胸腺细胞功能测定采用3H-TdR掺入法。在96孔板中, 加入1×107/ml胸腺细胞悬液100 μl/孔和3H-TdR 18.5 kBq/孔, 使终体积为200 μl/孔(三复孔), 置37 ℃、5% CO2条件下培养4 h。脾淋巴细胞功能测定采用有丝分裂原诱导转化法。在96孔板中, 加入5×106/ml脾细胞悬液100 μl/孔, 1 μg/孔Con A或4μg/孔LPS, 以RPMI 1 640培养基作对照, 使终体积为200μl/孔(三复孔)。置上述条件下培养72 h, 终止培养前6 h加入3H-TdR 18.5 kBq/孔。多头细胞收集器收集细胞, 液体闪烁计数器测定3H-TdR掺入量, 结果以cpm数表示。
1.6 统计学处理实验结果以x±s表示, MLT不同剂量之间或不同辐射剂量之间多组比较采用单因素方差分析(one-way ANOVA), 在同一辐射剂量点上对照组与MLT组之间采用t检验比较差异的显著性。
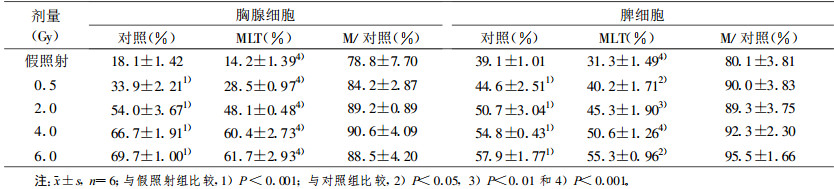
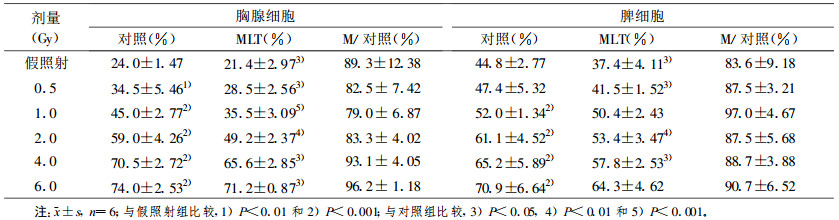
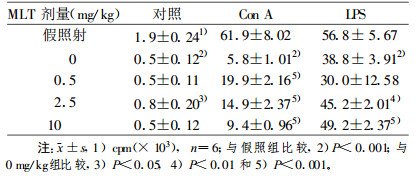
2 结果 2.1 MLT对电离辐射诱导胸腺和脾脏淋巴细胞凋亡的影响 2.1.1 MLT对不同剂量电离辐射诱导淋巴细胞凋亡的影响在0.5~6.0 Gy范围内胸腺和脾淋巴细胞凋亡小体百分率随照射剂量的增加而增加(P<0.001)。照射前预先加入2 mmol/L MLT, 凋亡小体百分率明显低于对照组(P<0.001, 表 1)。0.5~6.0 Gy体外照射后8 h, 胸腺和脾淋巴细胞DNA裂解率呈剂量依赖性增加(P<0.01或P<0.001)。照射前预先加入2 mmol/L MLT, DNA裂解率明显低于对照组(P<0.05~P<0.001, 表 2)。
|
|
表 1 MLT对不同剂量照射后8 h体外淋巴细胞凋亡的影响 |
|
|
表 2 MLT对不同剂量照射后8 h体外淋巴细胞DNA断片的影响 |
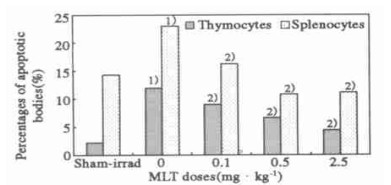
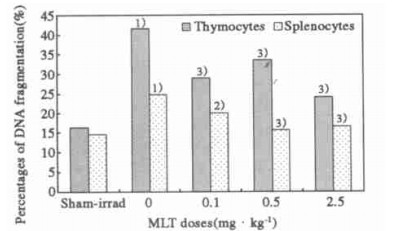
小鼠受2 Gy全身照射后, 胸腺和脾淋巴细胞凋亡小体百分率显著升高(P<0.001)。照射前60 min腹腔注射MLT可使其凋亡显著降低(P<0.001)。在0.1~2.5 mg/kg范围内, 随MLT剂量增加, 胸腺细胞凋亡逐渐降低, 接近假照水平, 剂量为2.5 mg/kg时仅为单纯照射组的37%。脾淋巴细胞凋亡下降更为明显, MLT剂量在0.5~2.5 mg/kg时, 凋亡小体百分率已经低于假照水平(图 1)。小鼠受2 Gy全身照射后, 胸腺和脾淋巴细胞DNA裂解率显著升高, P<0.001。照射前60 min腹腔注射MLT, 其DNA裂解率较单纯照射组显著降低(P<0.05或P<0.001), 接近假照水平, 脾细胞DNA裂解率下降较胸腺更明显(图 2)。
|
图 1 MLT注射1 h后小鼠接受2 Gy X射线照射后12 h淋巴细胞凋亡小体的变化 注:与假照组比较, 1) P<0.001; 与0 mg·kg-1组比较, 2)P<0.001。 |
|
图 2 MLT注射1 h后小鼠接受2 Gy全身照射后12 h淋巴细胞DNA断片的变化 注:与假照组比较, 1)P<0.001; 与0mg/kg组比较, 2)P<0.05和3)P<0.001。 |
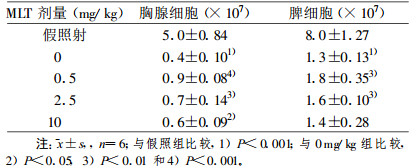
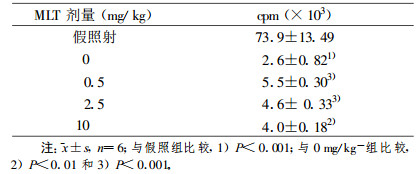
2 Gy全身照射后24 h, 胸腺和脾淋巴细胞数均显著低于假照组(P<0.001);预先腹腔注射0.5~10 mg/kg的MLT可使其细胞数显著增高, 0.5 mg/kg组较0 mg/kg组增高最显著(胸腺, P<0.001;脾, P<0.01), 见表 3。2 Gy全身照射后24 h, 胸腺细胞3H-TdR掺入率显著降低, 仅为假照组的3.48%(P<0.001);预先腹腔注射0.5~10 mg/kg的MLT, 其掺入率显著增高(P<0.01或P<0.001), 0.5 mg/kg组较0 mg/kg组增高最显著(P<0.001, 表 4)。2 Gy X射线全身照射后24 h, 有丝分裂原诱导的脾T、B细胞转化率均显著低于假照组(P<0.001)。照射前预先给予MLT, 在0.5~10 mg/kg体重剂量范围内, Con A诱导的T细胞转化率均显著高于0 mg/kg体重组(P<0.001), 以0.5 mg/kg体重组增高最显著; LPS诱导的B细胞转化率在0.5 mg/kg体重组未见明显变化, 而在2.5~10 mg/kg体重剂量范围内显著增高(P<0.01或P<0.001), 以10 mg/kg体重组增高最显著, 见表 5。
|
|
表 3 MLT注射1 h后小鼠接受2 Gy全身照射后24 h淋巴细胞数的变化 |
|
|
表 4 MLT注射1 h后小鼠接受2 Gy全身照射后24 h胸腺细胞3H-TdR掺入率的变化 |
|
|
表 5 MLT注射1 h后小鼠接受2 Gy全身照射后24 h脾淋巴细胞转化率的变化 |
我室既往资料表明, 中等以上剂量全身或体外照射可使小鼠淋巴细胞凋亡显著增高, 体外照射后4 h细胞凋亡明显增加, 且24 h内持续增加; 全身照射后, 细胞凋亡于12~14 h达峰值, 24 h回降。因此, 离体实验选择照射后8 h, 在体实验选择照射后12 h作为观察时间点。本研究离体结果表明, 体外照射可诱导小鼠胸腺和脾淋巴细胞凋亡, 使凋亡小体百分率和DNA裂解率显著增加, 在0.5~6.0 Gy范围内呈剂量依赖关系。照射前预先加入2 mmol/L MLT可显著降低辐射诱导的细胞凋亡。表明MLT在体外可减轻电离辐射诱导的淋巴细胞损伤, 对其具有保护作用。鉴于MLT的免疫调节作用具有时间相关性, 只有在机体内源性MLT分泌的上升时期给予MLT, 其免疫增强效应比较明显, 而在其余任何时间给予外源性MLT不能起到相应作用或作用不显著[7~9]。我们选择在19: 00 h给昆明小鼠腹腔注射MLT, 并选择其吸收峰值时间60 min给予2 Gy X射线全身照射, 观察MLT对电离辐射诱导的小鼠胸腺和脾淋巴细胞凋亡的影响。结果表明, 小鼠受2 Gy全身照射后, 胸腺和脾淋巴细胞凋亡小体百分率和DNA裂解率均显著升高, 而照射前预先补充MLT, 其细胞凋亡显著降低。胸腺细胞凋亡与MLT呈剂量依赖关系, 在0.1~2.5 mg/kg范围内, 随MLT剂量增加, 其凋亡小体百分率逐渐降低; 脾淋巴细胞凋亡下降更为明显, 在0.5~2.5 mg/kg MLT剂量范围内, 其凋亡小体百分率已低于假照水平。胸腺和脾淋巴细胞DNA裂解率也显著降低, 接近假照水平。表明MLT在体内对辐射所致小鼠淋巴细胞DNA损伤也有防护作用, 可减轻辐射诱导的淋巴细胞凋亡。综上可见, MLT在体内和体外对辐射诱导的淋巴细胞凋亡及DNA损伤都有防护作用, 并且在体内的防护作用更明显。体外MLT有效剂量为2 mmol/L, 体内为0.1~2.5 mg/kg。MLT拮抗辐射诱导的小鼠淋巴细胞凋亡, 可能与其抗氧化、抗自由基功能密切相关。MLT既可直接清除自由基, 又可刺激抗氧化酶活性发挥间接抗氧化作用。Reiter研究证实, MLT可激活过氧化酶类, 降低羟自由基前体H2O2的细胞内水平, 从而抑制自由基的产生, 这可能是MLT在体内抗辐射损伤作用较体外更明显的原因之一。Tan[10]通过32P标记DNA研究发现, MLT 0.2或0.4 mg/kg可使自由基对DNA破坏率分别下降为40%和99%, 表明MLT可对抗自由基对DNA的损伤。Menendez发现细胞核中的MLT浓度高于胞质; Castroviejo进一步发现, 肝细胞核中存在MLT受体, 提示MLT可能直接或间接地与其核受体结合, 从而调节基因的复制和转录过程。受体研究表明, 在鸟类、鼠类的免疫器官存在MLT特异结合位点[11, 12], 证实免疫组织是MLT作用的靶器官。新近用多聚酶链反应、核酸杂交和免疫荧光等技术研究发现, 鼠T、B细胞有MLT受体的mRNA表达, 进一步证实两种细胞是MLT作用的靶细胞。此外, Reiter等[13]发现MLT可以直接与DNA分子结合, 防止核苷酸的氧化。这些研究表明, MLT可能通过其核受体或直接与DNA分子结合, 防止或减轻电离辐射诱导的DNA氧化损伤, 拮抗辐射诱导的淋巴细胞凋亡, 从而对小鼠淋巴细胞发挥保护作用。
本研究结果表明, 2 Gy全身照射后24 h小鼠胸腺和脾淋巴细胞数量、胸腺细胞3H-TdR掺入率及有丝分裂原诱导的脾T、B细胞转化率均显著低于假照组, 这与我室既往研究结果一致。预先腹腔注射MLT 0.5~10 mg/kg体重, 胸腺和脾淋巴细胞数显著增高, 0.5 mg/kg体重组增高最显著; 胸腺细胞3H-Td R掺入率显著增高, 0.5 mg/kg体重组增高最显著; Con A和LPS诱导的脾T、B细胞转化率也显著增高。以上结果提示, MLT对电离辐射所致机体免疫功能抑制具有拮抗作用。这种机制, 可能是MLT分子直接与T、B细胞上的MLT受体结合, 在免疫细胞局部发挥抗氧化、抗自由基作用, 从而减轻电离辐射产生的自由基对小鼠淋巴细胞的损伤, 降低淋巴细胞凋亡, 并最终在整体上表现为淋巴细胞数量增多和功能增强。
| [1] |
Maestroni GJM, Pierpaoli W.Pharmacologic control of the hormonally mediated immune response.In: Psychoneuroimmunology [J]. New York: Academic Press, 1981, 405-413.
|
| [2] |
Blinkenstaff RT, Brandstastadter SM, Reddy S, et al. Potential radiopr otective agents. 1. homologs of melatonin[J]. J Pharm Sci, 1994, 83: 216-218. DOI:10.1002/jps.2600830220 |
| [3] |
Vijayalaxmi R, Reiter RJ, Meltz ML. Melatonin protects human blood lymphocytes from radiation-induced chromosome damage[J]. Mutat Res, 1995, 346: 23-31. DOI:10.1016/0165-7992(95)90065-9 |
| [4] |
Vijayalaxmi, Reiter RJ, Herman TS, et al. Melatonin reduces gamma radiation-induced primary DNA damage in human blood lymphocytes[J]. Mutat Res, 1998, 397: 203-208. DOI:10.1016/S0027-5107(97)00211-X |
| [5] |
Koc M, Taysi S, Emin BM, et al. The effect of melatonin against oxidative damage during total-body irradiation in rats[J]. Radiat Res, 2003, 160(2): 251-255. |
| [6] |
Erol FS, Topsakal C, Ozveren MF, et al. Protective effects of melatonin and vitamin E in brain damage due to gamma radiation an experimental study[J]. Neurosurg Rev, 2004, 27(1): 65-69. DOI:10.1007/s10143-003-0291-8 |
| [7] |
Del Gobbo V, Libr V, illani N, et al. Pinealectomy inhibits interleukin-2 production and natural killer activity in mice[J]. Int J Immunopharmacol, 1989, 11(5): 567-569. DOI:10.1016/0192-0561(89)90187-2 |
| [8] |
Claudio PM, Caroleo C, Nistico G, et al. Melatonin increases antigen presentation and amplifies specific and non-specific signals for T-cell proliferation[J]. Ibid, 1993, 15(4): 463-464. |
| [9] |
Maestroni GJM, Conti A, Pierpaoli W. Role of the pineal gland in immunity, circadian synthesis and release of melatonin modulates the antibody respose and antagonizes the immunosuppressive effect of corticosterone[J]. J Neuroimmunol, 1986, 13: 19-21. DOI:10.1016/0165-5728(86)90047-0 |
| [10] |
Tan DX, Poeggler B, Reiter RJ, et al. The pineal hormone melatonin inhibits DNA-adduct formation induced by the chemical carcinogen safrole in vivo[J]. Cancer Lett, 1993, 70: 65-71. DOI:10.1016/0304-3835(93)90076-L |
| [11] |
赵瑛, 邵福源, 吴萍嘉. 鸟类胸腺降黑素受体的鉴定及其意义[J]. 标记免疫分析与临床, 1996, 3: 20-21. |
| [12] |
魏伟, 徐叔云. 免疫系统褪黑素结合位点的研究进展[J]. 中国药理学通报, 1996, 12(5): 392-394. DOI:10.3321/j.issn:1001-1978.1996.05.004 |
| [13] |
Liu ZM, Pang SF. 125I iodomelatonin binding sites in the bursa of fabricius of birds:binding characteristics, subcellular distribution, diurnal variation and age studies[J]. J Endocrinol, 1993, 138: 51-52. DOI:10.1677/joe.0.1380051 |



 ,
,