肿瘤的放射治疗仍然是目前临床上应用最广泛和最重要的治疗手段之一, 但长期以来, 肿瘤临近部位正常组织的放射损伤及外周血淋巴细胞的下降影响着放疗疗效和应用, 如何尽可能减轻正常组织的辐射损伤, 增强机体的免疫力, 是肿瘤放射治疗必须解决的关键问题。恶性肿瘤患者机体免疫功能与正常生理状态不同, 更重要的是肿瘤患者在放疗和化疗过程中机体免疫功能下降。淋巴细胞是机体抗肿瘤免疫的最主要成分, 其结构及功能正常与否是机体免疫系统发挥其抗瘤作用的基础[1]。而淋巴细胞又是辐射敏感性最高的细胞之一, 在电离辐射的直接作用和自由基(ROS)的间接作用下易引起DNA损伤。生物的辐射抗性除与本身DNA损伤修复能力有关外, 还与体内所含氧化保护酶(SOD、GSH-Px、CAT)有关[2]。我们的研究证明低剂量辐射在增强局部抗瘤效果的同时, 能保护和减轻外周血淋巴细胞DNA损伤(另文报道)为了探索其机制, 本实验观察了低剂量辐射对荷瘤鼠放疗后血清中抗氧化酶活性的影响。
1 材料与方法 1.1 动物模型的制备 1.1.1 实验动物中国医学科学院放射所培育的IRM-2纯近交系小鼠, 体重(23±2)g, 雌雄各半, 检疫1周后分组接种淋巴瘤细胞。
1.1.2 淋巴瘤细胞种植在无菌条件下取荷瘤鼠淋巴瘤新鲜瘤组织, 加生理盐水匀浆后制成瘤细胞悬液, 取0.1 ml(约106个细胞)于小鼠右侧小腿外侧皮下注射。
1.2 实验动物分组接种6 d左右选取肿瘤结节达0.5 cm左右的荷瘤鼠, 随机分成三个大组, 单次照射组、连续3 d照射组(1次/d)、连续5 d照射组(1次/ d), 每个大组再分四个小组:①对照组:不作任何处理的荷瘤鼠组, 包括a1、a3、a5 ②低剂量组:每次5 cGy低剂量全身照射, 包括b1、b3、b5 ③局部放疗组:每次2.0 Gy局部照射, 包括c1、c3、c5 ④低剂量+局部放疗组:每次2.0Gy局部放疗前6 h接受5 cGy低剂量全身照射, 包括d1、d3、d5。
1.3 照射条件用137Cs γ射线(Cammacell 40加拿大产)为照射源, 低剂量辐射全身均匀照射5 cGy(剂量率0.054 Gy/min); 荷瘤鼠局部放疗, 将荷瘤鼠固定在特制装置上, 以铅板屏蔽除右下肢以外的部位, 一次2.0 Gy, (剂量率0.87 Gy/min)。
1.4 检测指标及方法抗氧化物酶活力测定超氧化物歧化酶(SOD)和谷胱甘肽-S转移酶(GST)、过氧化氢酶(CAT)活性测定分别采用羟胺法和比色法测定。测试盒均购自南京建成生物工程研究所。
1.5 统计学处理数据处理用SPSS11.5软件系统, 两组间均数比较采用单因素方差分析。
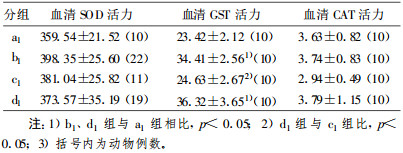
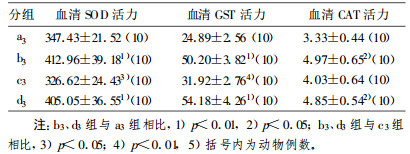
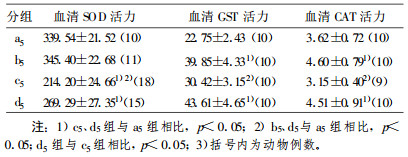
2 结果LDR对荷瘤鼠放疗后血清抗氧化活性的影响见表 1~表 3。表中括号内数字为动物例数。由表 2可见:①低剂量全身照射组(b1 b3 b5)血清中SOD、GST、CAT活力都高于相应对照组(a1 a3 a5), 提示低剂量辐射能使血清中SOD、GST和CAT活力上升; ②低剂量+局部放疗组(d3 d5)血清中SOD、GST、CAT活力都显著高于局部大剂量组(c3 c5); 连续3 d低剂量全身照射组(b3)血清中SOD、GST、CAT活力显著高于b1、b5组(p<0.05), 连续3 d低剂量+局部放疗组(d3)血清中SOD、GST、CAT活力同样显著高于d1、d5组(p<0.05), 提示本实验中连续3 d低剂量全身照射诱导剂量最佳。
|
|
表 1 一次照射组SOD、GST、CAT活性测定(x±s) |
|
|
表 2 连续3 d照射组SOD、GST、CAT活性测定(x±s) |
|
|
表 3 连续5 d照射组SOD、GST、CAT活性测定(x±s) |
电离辐射对生物体构成损伤, 主要来自两方面的作用, 一是辐射能量传递的直接作用, 二是间接作用, 即通过激活水分子产生活性氧基(ROS)如02、OH、H2O2, 它们可直接作用于细胞DNA使之受损或链断裂, 同时在ROS作用下细胞修复系统对氧化损伤DNA的修复速度明显减慢。ROS还可损伤蛋白质和直接引发细胞膜的脂质过氧化。ROS造成的损伤约占放射损伤的2/3[3], 氧化损伤累积到一定程度就会导致严重的生物效应, 促进细胞发生有丝分裂、突变及死亡。为着自身保护的需要, 生物在进化中形成了一系列消除自由基的酶类, 细胞内的内源性抗氧化剂在基因的调控下, 清除一部分多余的活性氧, 从而对DNA、蛋白质、生物膜等产生保护作用。本实验结果显示:低剂量辐射能使血清中SOD、GST、CAT活力上升; 荷瘤鼠预先接受5cGy γ射线全身照射后6 h局部放疗组血清中SOD、GST、CAT活力显著高于局部大剂量组; 尤以连续3 d照射组明显, 这表明:LDR能使抗氧化酶的活性升高, 迅速清除大剂量电离辐射产生的过量ROS, 防止和移去DNA损伤, 从而避免了大剂量辐射对肿瘤临近正常组织、器官的氧化损伤, 其中包括对免疫系统的保护作用, 表现为荷瘤鼠在接受局部大剂量照射前6 h全身小剂量照射能使外周血淋巴细胞DNA的损伤减轻。淋巴细胞是机体抗肿瘤免疫的最主要成分, 其结构及功能正常与否是机体免疫系统发挥其抗瘤作用的基础。Bravard A[4]等报道, 人淋巴母细胞AHH-1受0.02 Gy γ射线照射后6 h接受3 Gy γ射线照射, 一系列抗氧化酶活性较只接受3 Gy照射的对照组有轻度升高。本实验结果与上述报道相一致。抗氧化物对自由基的清除在LDR促发的保护性机制中起着重要的保护作用。低剂量辐射诱导抗氧化作用是低剂量辐射诱导适应性反应的机制之一[5, 6]。抗氧化酶对受照射荷瘤鼠外周血淋巴细胞具有辐射防护功能, 使荷瘤机体免疫系统发挥其抗瘤作用, 因而可以认为:低剂量辐射激活荷瘤机体抗氧化物酶可能是低剂量辐射抑瘤作用的部分机制。
| [1] |
陈慰峰. 医学免疫学[M]. 北京: 人民卫生出版社, 2000: 226-234.
|
| [2] |
刘永彪, 刘颖, 赵杰, 等. SOD对肿瘤细胞凋亡影响和抗氧化损伤的研究[J]. 辐射研究与辐射工艺学报, 2004, 22(3): 165-170. DOI:10.3969/j.issn.1000-3436.2004.03.008 |
| [3] |
刘青杰, 封江彬, 陆雪. 线粒体基因及其在辐射生物学中的研究进展[J]. 辐射研究与辐射工艺学报, 2004, 22(2): 65-67. DOI:10.3969/j.issn.1000-3436.2004.02.001 |
| [4] |
Bravard A, Luccioni C, Moustacchi E. Contribution of antioxidant enzymes to adaptive response to ionizing radiation of human lymphoblast[J]. Int J Radiat Biol, 1999, 75(5): 639-645. DOI:10.1080/095530099140285 |
| [5] |
Lehnert BE, Iyer R. Exposure to low -level chemicals and ionizing radiation :reactive oxygen species and cellular pathways[J]. Hum Exp Toxicol, 2002, Feb; 21(2): 65-9. |
| [6] |
Narayanan P.K, Goodwin EH, Lehnert BE. Alpha particles initiate biological production of superoxide anions and hydrogen peroxide in human cells[J]. Cancer Res, 1997, 57(9): 3963-3971. |