2. 青岛大学医学院附属医院;
3. 青岛市出入境检验检疫局
随着介入放射治疗技术的迅速发展, 从事该工作的人员辐射损伤越来越受到关注, 当机体受到一定剂量的电离辐射作用后, 外周血淋巴细胞和骨髓淋巴细胞中早期即可见到染色体的改变, 即染色体畸变。稳定性染色体畸变如易位、插入等在照后若干年, 仍可在受照者体内基本保持恒定, 因此国内外一些从事辐射远后效应研究机构多采用分析稳定性染色体畸变为主要指标, 通过对受照者的随访观察, 作为远期健康影响的评估指标。易位的检出通常采用G-显带技术, 由于其费时费力, 技术要求高, 很难推广。本课题应用FISH技术进行染色体畸变研究以观察远后效应具有重要意义。
1 材料与方法 1.1 研究对象的选择射线组为从事X射线介入治疗人员30名, 均为男性, 接触射线的工龄范围为5~24 a, 平均放射工龄为15 a, 对照组30名, 为同工作条件、同年龄段、同性别的不接触射线的医务工作者。
1.2 方法常规方法进行外周血淋巴细胞培养及染色体中期相制备; 荧光原位杂交所用试剂为1#、4#全染色体探针和检验试剂盒为英国Cambia公司的产品。为了获得一个稳定的FISH方法实验条件, 根据该公司介绍的操作方法和试验步骤及借鉴国内相关试验的成功经验, 具体实验方法包括:人外周血淋巴细胞培养及染色体中期相制备、探针变性、标本处理、杂交、洗片、信号检测及放大、复染、染色体畸变识别及记录、Giemsa染色复核等步骤; 正常中期中有两对绿色全荧光染色体。根据大小可区别1#、4#染色体。双色(黄绿色红色)染色体上有一个着丝粒为易位。两个双色染色体上有一个着丝粒(用Giemsa校正)为完全易位, 只见到一个双色染色体, 伴或不伴无着丝粒断片, 断片为全荧光或双色为不完全易位。完全易位、不完全易位和插入均记为一个畸变。双色染色体上有两个着丝点者为双着丝粒。双色或只带黄绿色荧光, 且不含着丝粒的染色体断片为无着丝粒断片。若一个易位或双着丝粒只伴有一个无着丝粒断片, 则该无着丝粒断片不单独记数。
1.3 统计学分析采用《医学统计方法》 [1]中普哇松分布检验或卡方检验。
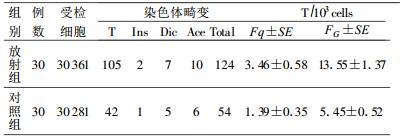
2 结果 2.1 介入放射人员和对照组染色体畸变分析结果(表 1)|
|
表 1 放射组与对照组染色体畸变比较 |
结果显示, 放射组发现易位105个, 对照组检出易位42个, 两组人员的染色体易位占总畸变的82%, 其中放射组的易位检出占总畸变的85%、对照组的易位检出占总畸变的78%, 说明易位在畸变中占主要份额。放射组染色体易位率、总畸变率显著高于对照组, 经普哇松分布分析, 两组总畸变率与染色体易位率差异均有显著性(P<0.01)。根据Lucas等[2]推荐的公式FG=Fp/2.05fp(1-fp), 将染色体易位率Fp换算为全基因组易位率FG, fp为全染色体在基因组中所占份额。
2.2 不完全易位与完全易位的比较放射组和对照组中完全易位均多于不完全易位, 但两组构成差异无显著性, 经χ2分析, P>0.05(χ2=0.01)。
2.3 易位的类型比较按染色体易位的着丝点部位分成, 着丝点位于不带荧光部分与着丝点位于带荧光部分两种, 可见两组着丝点位于不带荧光部分, 均明显多于着丝点位于带荧光部分, 但两组构成差异无显著性, 经χ2分析, P>0.05(χ2 =0.03)
2.4 1#和4#染色体易位的比较使用1#和4#全染色体探针对两组人员进行的分析中, 所观察到的1#和4#染色体易位数接近, 且构成差异无显著性, 经χ2分析, P>0.05(χ2=0.01)。
2.5 不同放射工龄组染色体易位结果比较(表 2)|
|
表 2 不同放射工龄组染色体畸变比较 |
可见, 染色体易位率和总畸变率有随着放射工龄的增加而明显增高的趋势。
3 讨论许多实验结果表明, 稳定性染色体畸变尤其易位, 在照后若干年甚至数十年仍存留在受照者体内, 其频率基本保持恒定。本研究结果与某些实验室的结果是一致的, 金璀珍[3, 4]等报道了用常规细胞遗传学方法对其染色体进行分析, 观察结果为稳定性畸变占总畸变的65%, 并且稳定性畸变随累积剂量增加而增加。王知权[5]等用G-显带方法分析了84例医用诊断工作者和17例对照组人员的染色体畸变情况, 结果表明稳定性畸变占总畸变的67%, 其中相互易位占稳定性畸变的58%, 表明稳定性染色体畸变能在体内保持相对恒定。
3.1 不完全易位与完全易位易位的持久性问题对观察远后效应是一个关键因素, 有关的文献报道有两种观点:一是认为含有易位畸变的细胞可以随细胞分裂而下传, 所以可出现在成熟的淋巴细胞中; 而另一种观点则认为对事故受照人员的随访中, 发现照后一定时间易位率明显下降, 其中主要是单向型易位———即不完全易位下降, 而双向型易位———即完全易位则较恒定。Sevankaev[6]等发现在染色体易位畸变中, 完全易位占67%, 不完全易位也占有相当比例, 二者均能在体内保持相对恒定, 故认为应以总易位率作为回顾性剂量估算指标, 但Moquet等[7]一些报道不支持易位持续不变的观点。
3.2 易位类型与Kodama等[8]的实验结果相吻合, 他认为通过FISH技术能够检出的带荧光的最小染色体易位片段约11.1 Mb, 而不带荧光的最小检出片段约14.6 Mb, 所以后者明显多于前者, 与本实验结果相同。Tucker[9]认为这可能与端粒的放射敏感性高有关, 因FISH技术中靶染色体占少数, 而多数为非靶染色体, 因此受照后断裂点发生在非靶染色体端粒处较多, 因此较易形成T(Ab)。即使形成T(Ba), 也会因不带荧光部分DN A含量太小而难以分辨。Guerrrer等[10]的离体实验也观察到了相同的结果。
3.3 1#、4#染色体易位情况用FISH技术检测辐射诱发的染色体易位率进而估算其剂量, 首先应将发生在靶染色体上的易位率通过公式换算成全基因组的畸变率。之所以能进行这种换算是根据下述假设:假设辐射引起的染色体断裂点在基因组中是随机分布, 任何一对染色体没有优先发生互换的特殊性。这样任何一条染色体发生易位的几率就和其DNA含量成正比。本研究的结果支持这一假设。尽管1号染色体DNA物理长度是4号染色体的1.3倍, 所观察到的易位数却无明显差异, 说明4号染色体较1号染色体容易发生染色体互换畸变, 这与国外一些研究结果相一致。
3.4 染色体易位率比较放射人员的染色体易位率随放射工龄的增加而增加, 这说明放射人员的受照剂量在累积。许多研究者的实验表明早先受照者的染色体易位率反映的是最初染色体损伤的情况, 染色体易位的累积也反映了剂量的累积, Stephan的研究[11]就是对这一结论的论证。
近年来, 国外许多学者的研究结果不同于这一观点, Lindholm[12]等对20名核工厂职业受照者用传统G-显带和FISH方法分析其染色体易位率, 发现累积剂量与易位率呈正相关, 而个体间的易位率与个人的累积剂量无明显线性关系, 作者考虑这可能与易位率个体间差异有关, 本底易位率可受多种因素的影响, 比如年龄、吸烟等。与之相似的是Cigarran等[13]的实验研究。
FISH技术由于图像清晰和分析快速的优点, 以及对分裂项要求不那么严, 对分析者技能要求不那么高的特点, 从而解决了剂量估计需要分析大量细胞的难题。和常规法相比, 对易位畸变的判断速度快, 准确性也高, 近年来在剂量重建研究中得到应用与重视。对FISH技术的实用价值也逐渐积累了不少资料。不足之处是试验所需的探针和试剂及设备成本尚高, 目前国内尚无法普及和推广。作为方法的本身, 因辐射诱发畸变的复杂性, 至今尚无完整的记录系统。
| [1] |
上海第一医学院卫生统计学教研组编. 医学统计方法[M]. 上海: 上海科学技术出版社, 1979.
|
| [2] |
Lucas JN. Rapid human chromosome aberration analysis using fluorescence in situ hybridization[J]. Int J Radiat Biol, 1989, 56: 201. DOI:10.1080/09553008914551351 |
| [3] |
金璀珍, 袁志强, 杨捷. 职业受照人员的稳定性染色体畸变观察[J]. 辐射防护, 1984, 4(6): 425. |
| [4] |
金璀珍, 刘秀林, 张泽云, 等. 上海6.25雇员事故受照者后4—6年细胞遗传学随访观察[J]. 中华放射医学与防护杂志, 1998, 18: 21. DOI:10.3760/cma.j.issn.0254-5098.1998.01.006 |
| [5] |
Wang ZQ, Liu XP, Li J, et al. A retrospective dosimetry in medical diagnostic X-ray workers in China by FISH[J]. Radiat Prot Dosim, 1998, 77(1-2): 87. |
| [6] |
Sevankaev, Figgitt M. Novel data set for retrospective biodosimetry using both conventional and FISH chromosome analysis after high accidental overexposure[J]. Applied Radiat Isotopes, 2000, 52: 1149-1152. DOI:10.1016/S0969-8043(00)00062-2 |
| [7] |
Moquet JF, Edwards AA, Lloyd DC, et al. The use of FISH chromosome painting for assessment of old doses of ionizing radiation. painting[J]. Radiat Prot Dosim, 2000, 88: 27-33. DOI:10.1093/oxfordjournals.rpd.a033016 |
| [8] |
Kodama Y, Nakano M, Ohtaki K, et al. Estimation of minimal size of translocated chromosome segments detectable by fluorescence in situ hybridization[J]. Int J Radiat Biol, 1997, 71: 35-39. DOI:10.1080/095530097144391 |
| [9] |
Tucker JD, Lee DA, Moore DH. Validition of chromosome painting.Ⅱ. A detailed analysis of aberrations following high doses of ionizing radiation in vitro[J]. Int.J.Radiat.Biol, 1995, 67: 19-28. DOI:10.1080/09553009514550031 |
| [10] |
Guerrrer YC, Egozcue J. The persistence of FISH translocations for retrospective biological dosimetry after simulated whole or partial body irradiation Radiat Protect[J]. Dosimetry, 1998, 76: 159-168. |
| [11] |
Stephen G, Pressl S. Chromosome aberration in human lymphocyte analysed by fluorescence in situ hybridization after in vitro irradiation and in radiation workers, llyears after an accident radiation exposure[J]. Int, J Radiat Biol, 1997, 3: 293. |
| [12] |
LindholmC, Salomaa S, Tekkel M, et al. Stable and unstable chromosomal aberrations among finnish nuclear power plant workers Radiat Protect[J]. Dosimetry, 2001, 93: 143-150. |
| [13] |
Cigarran S, Barquinero JF, Barrios L, et al. Cytogenetic analses by fluorescence in situ hybridization (FISH)in hospital workers occupationally exposed to low levels of ionizing radiation[J]. Radiat Res., 2001, 155: 417-423. DOI:10.1667/0033-7587(2001)155[0417:CABFIS]2.0.CO;2 |