低剂量化学因子诱导的适应性反应表现为两个方面, 首先是低浓度化学因子产生的兴奋效应。低浓度乙酸和丙酸不仅对大肠杆菌利用碳源有促进作用, 而且在pH中性条件下, 低浓度乙酸钠和丙酸钠也能增加大肠杆菌的繁殖。这种现象与大肠杆菌合成基因和鞭毛基因的表达, 增加大肠杆菌蛋白质合成, 提高其活动性有关[1]。其次是拮抗中等以上剂量物理或化学因子的损伤。预先给予人血淋巴细胞MMC(丝裂霉素C)处理, 6 h后给予1.5 Gy X射线照射, 可诱导人血淋巴细胞染色体畸变的交叉适应性反应。预先给予低浓度MMC和H2O2, 24 h后给予1.5 Gy X射线照射, 低浓度MMC和H2O2可以诱导抗X射线损伤的交叉适应性反应[2]。笔者通过小鼠脾淋巴细胞增殖研究H2O2和CP对辐射损伤小鼠脾淋巴细胞增殖的影响, 探讨低浓度化学因子诱导适应性反应的机制。
1 材料与方法 1.1 仪器和设备AEG-220型电子天平(日本SHIMADZU公司), ZT-Ⅱ型多头细胞收集器(浙江电子医疗仪器厂), LS-6000SC型标准架液体闪烁系统(美国BECKMAN公司), SW-CJ-1D型净化工作台(苏州净化设备厂), CK2型倒置显微镜(日本OLYMPUS公司), SZ-97型自动三重纯水蒸馏器(上海亚荣生华仪器厂), CS-101-2AB型电热鼓风干燥箱(重庆银河试验仪器有限公司), 微量加样器(法国Gilson公司), F34-1深部X射线治疗机(北京)等。
1.2 主要试剂RPMI 1640培养基(美国GIBCO公司), 新生小牛血清(杭州四季青公司), 3H-TdR(中科院上海原子核研究所), Con A(刀豆球蛋白A, Concanavalin A)和LPS(脂多糖, lipoperoxide)均为美国SIGMA公司产品, H2O2(广州化学试剂厂), CP(上海华联制药有限公司)。H2O2和CP均配制成10-6、10-5、10-4、10-3、10-2 mol/L 5个浓度。
1.3 照射条件200 kV, 10 mA, 滤过板为0.5 mmCu, 1.0 mmAl。剂量率为0.689 Gy·min-1, 吸收剂量为10Gy。在细胞培养至56 h时, 给予X射线一次性照射。
1.4 小鼠脾细胞悬液制备脱臼处死6只雄性昆明小鼠, 无菌条件下取出脾脏, 置于盛有RPML 1640培养液的培养皿中, 用毛玻璃研磨脾脏, 用200目尼龙网过滤制成单细胞悬液, 显微镜下计数, 用RPMI 1640培养液稀释成5×10-6/ml脾细胞悬液。
1.5 小鼠脾淋巴细胞增殖实验在96孔培养板中加入配好的5×106/ml脾细胞悬液, 100μl/孔, 然后每孔加入ConA(10μg/ml) 50 μl或LPS(40μg/ml) 50 μl。对照组加50μl培养液, 实验组加50μl用培养液配制的不同浓度的H2O2和CP。小牛血清终浓度为10%, 三复孔培养。于37℃, 5 %CO2培养箱中培养66 h后, 加入30 μl已配好的3H-TdR液(终浓度为18.5 kBq/ml), 继续培养6 h。多头细胞收集器将细胞收集于玻璃纤维滤纸上, 80 ℃烘干, 置于玻璃闪烁杯中, 加入10 ml闪烁液, 应用标准架液体闪烁系统测3H-TdR掺入量。
1.6 统计学处理根据实验组与对照组cpm值的百分率, 用SPSS10.0系统进行单因素方差分析。
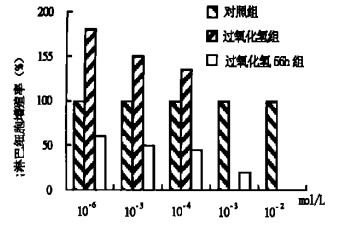
2 结果 2.1 过氧化氢对小鼠脾淋巴细胞增殖的影响图 1为H2O2与Con A同时作用于脾淋巴细胞和Con A作用于细胞56 h再加入H2O2而引起小鼠脾淋巴细胞增殖变化的直方图。从图 1可以看出, 10-6mol/L和10-5 mol/L的H2O2组小鼠脾淋巴细胞增殖率明显高于对照组, 但H2O2在Con A诱导细胞56 h再作用于细胞时, 小鼠脾淋巴细胞增殖率明显低于对照组。H2O2浓度≥10-5 mol/L(与Con A同时加入)和H2O2浓度≥10-3 mol/L (在Con A刺激细胞56 h加入)实验组小鼠脾淋巴细胞增殖均显著低于对照组。
|
图 1 过氧化氢对小鼠脾淋巴细胞增殖的影响 |
图 2为不同剂量的CP对Con A和LPS诱导的小鼠脾淋巴细胞增殖的剂量效应曲线。从图 2可以看出, 10-6 mol/L和10-5 mol/L的CP组小鼠脾淋巴细胞增殖率略高于对照组, 但无统计学意义。当CP浓度≥10-4 mol/L(LPS组)和CP浓度≥10-3 mol/L(LPS组)时, 小鼠脾淋巴细胞增殖率显著低于对照组(P<0.01) ”

|
图 2 环磷酰胺对小鼠脾淋巴细胞增殖的影响 |
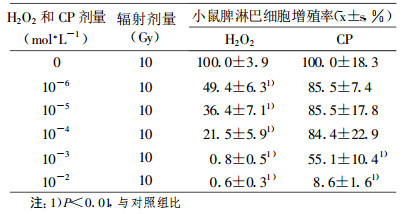
表 1显示Con A、H2O2和CP作用于小鼠脾细胞56 h, 再接受10 Gy X射线照射, 小鼠脾淋巴细胞增殖的变化。从表 1可以看出, H2O2浓度≥10-6mol/L组和CP浓度≥10-3mol/L组的小鼠脾淋巴细胞增殖率显著低于对照组(P<0.01)。
|
|
表 1 H2O2和CP对辐射损伤小鼠脾淋巴细胞增殖的作用 |
低浓度化学因子诱导的适应性与多种因素有关。10-8 mol/L和10-7 mol/L的CP对小鼠脾淋巴细胞增殖有明显的促进作用, 而10-3mol/L的CP对小鼠胸腺细胞自发增殖有显著的促进作用[3]。10-6mol/L和10-5mol/L的H2O2对小鼠脾淋巴细胞增殖有明显的促进作用, 而H2O2浓度进一步增加则表现为抑制作用。H2O2在Con A诱导56 h加入, 小鼠脾淋巴细胞增殖没有增加反而降低, 说明淋巴细胞经过Con A的刺激处于DN A和蛋白质合成期前期, 对H2O2非常敏感, 未产生适应性反应(图 1)。另外, 与H2O2相同浓度的CP并不能诱导适应性反应(图 2), 提示适应性反应的产生不仅与化学因子的剂量和作用时间有关, 而且与化学因子的种类也有联系。给小鼠低浓度咖啡因处理4 h, 再使其接受损伤剂量甲基黄酸乙酯(Ethyl methylsulfonate, EMS), 结果发现小鼠骨髓染色体畸变率明显低于单纯接受损伤剂量EMS组, 表明咖啡因诱导了抗EMS损伤的遗传学适应性反应[4]。低浓度化学因子也可以诱导抗损伤性物理因子的交叉适应性反应。低浓度的丝裂霉素C预处理小鼠24 h, 再给予1.5 Gy X射线辐射, 结果发现小鼠骨髓细胞和生殖细胞染色体畸变率均明显低于单纯1.5Gy X射线辐射处理组, 表明丝裂霉素C可以诱导抗1.5Gy X射线辐射损伤的适应性反应[5]。表 1结果显示H2O2和CP未能诱导抗10 Gy X射线照射的适应性反应, 可能的原因是体外培养的细胞缺乏神经、内分泌和免疫系统的调节, H2O2和CP不能诱导抗大剂量辐射的适应性反应。另外, 观察指标的不同也影响适应性反应的产生。低浓度过氧化氢处理淋巴细胞, 再给以2 Gy损伤剂量γ射线照射, 细胞凋亡水平明显高于单纯2 Gy照射组。表明低浓度过氧化氢可以诱导γ射线凋亡的适应性反应[6]。因此, 低浓度化学因子诱导适应性反应的机理是非常复杂的, 不仅与低浓度化学因子的种类、剂量、作用方式等因素有关, 而且与观察指标、损伤因子的种类和剂量也有密切的联系。
| [1] |
Polen T, Rittmann D, Wendisch VF, et al. DNA microarray analyses of the long-term adaptive response of Escherichia coli to acetate and propionate[J]. Appl Environ Microbiol, 2003, 69(3): 1759-1774. |
| [2] |
孟庆勇, 蔡露, 金玉珂. 低剂量X射线和低浓度MMC、H2O2、CP诱导人血淋巴细胞、小鼠骨髓细胞和生殖细胞的交叉适应性反应[J]. 辐射防护, 2002, 22(4): 212-218, 252. DOI:10.3321/j.issn:1000-8187.2002.04.004 |
| [3] |
罗洪清, 孟庆勇. 不同剂量环磷酰胺对正常小鼠淋巴细胞增殖反应的影响[J]. 癌变.畸变.突变, 2003, 15(2): 79-81. |
| [4] |
Harish SK, Guruprasad KP, Mahmood R, et al. Inducible protective processes in animal systems Ⅵ.Cross-adaptation and the influence of caffeine on the adaptive response in bone marrow cells of mouse[J]. Mutagenesis, 2000, 15(3): 271-276. DOI:10.1093/mutage/15.3.271 |
| [5] |
孙淑清, 王彬, 姜杰. 低浓度丝裂霉素C诱导抗大剂量辐射照射的适应性反应[J]. 辐射防护, 1998, 18(1): 45-48. |
| [6] |
Cregan SP, Brown DL, Mitchel RE. Apoptosis and the adaptive response in human lymphocytes[J]. Int J Radiat Biol, 1999, 75(9): 1078-1094. |