2. 吉林大学卫生部放射生物学重点实验室
中等剂量电离辐射诱导体内外细胞发生G1期阻滞, p53-p21通路在其形成中发挥重要调控作用[1, 2]。然而, 另一条非p53依赖的细胞周期负向调控通路p16-cyclinD/CDK4-pRb在电离辐射诱导G1期阻滞中的作用尚不十分清楚, 本实验采用多种分子生物学方法观察电离辐射对脾细胞p16、CyclinD、CDK4基因转录和蛋白表达的影响并探讨它们在辐射诱导的G1期阻滞中的重要生物学意义。
1 材料与方法 1.1 动物分组及处理雄性昆明种小鼠, 体重(20±2) g, 吉林大学白求恩医学部实验动物室提供。将动物随机分成假照射组和不同时间点照射组, 每组15只鼠。时程实验: 2 Gy照后4 h、8 h、12 h、24 h、48 h、72 h检测, 于上述各时间点断头处死小鼠, 迅速取脾脏, 制成单细胞悬液, PBS洗二次后备用。
1.2 照射条件国产X射线深部治疗机, 电压200 kV, 电流10 mA, 滤片0.5 mmCu+1.0 mmAl, 剂量率0.287 Gy/min, 靶皮距56 cm; 照射剂量2 Gy。
1.3 探针鉴定从含鼠CDK4重组质粒(美国Chales J博士惠赠)酶切出CDK4片段(1.2kb), p16、CyclinD和GAPDH经PCR和RT-PCR扩增后, 1.2 %琼脂糖凝胶电泳分析, 特异片段长度p16 : 340 bp, CyclinD : 568 bp, GAPDH: 746 bp(见图 1)

|
图 1 p16, CyclinD, CDK4和GAPDH探针电泳带 |
采用异硫氰酸胍一步法提取总RNA。方法简述如下, 2×107个细胞, 加入1 ml异硫氰酸胍裂解液, 混匀, 加100 μl乙酸钠(pH4.0), 混匀, 加等体积水饱和酚, 混匀, 加200 μl CH4Cl3/ISA(49: 1), 混匀, 4 ℃15 min。低温离心(12000r.min-1)) 10 min, 小心吸取上层水相置于另一Eppendorf管中, 加等体积异丙醇, 混匀, -20 ℃沉淀RNA至少30 min。低温离心(12000 r.min-1) 15 min, 弃上清, 加200 μl 75 %乙醇沉淀, 干燥后溶于100 μl无RNase水中, 紫外测RNA纯度及含量, -70 ℃贮存备用。转膜、杂交、洗膜参见常规分子生物学技术。采用随机引物法标记探针, 详见厂家说明书。用Phosphor Imager同位素标记激光扫描成像仪检测杂交带的平均灰度, 结果用特异探针杂交带与GAPDH杂交带平均灰度的比值表示。
1.5 半定量RT-PCR方法取1 μg总RNA置于20 μl反转录体系, 42 ℃60 min, 95 ℃ 5min变性后, 4 ℃放置。取cDNA 5 μl作为模板, 置于50 μl体系中扩增(同时加入CyclinD和mGAPDH引物)。条件为94 ℃ 1 min, 64 ℃ 1 min, 72 ℃1 min, 循环35圈, 72 ℃ 10 min。扩增产物在1.0 %琼脂糖凝胶上电泳后呈现清晰条带, 紫外图象扫描仪扫描并分析电泳带的平均灰度, 结果以特异泳带与GAPDH泳带平均灰度的比值表示。GAP DH引物: 5′ -TATTGGGGCGCCGGGTCACCA-; 3′ -CCACCTTCTTGATGTCATCA-, 扩增片段长度746bp。CyclinD引物: 5′ -GCTCCTCTTCCTTCCCACTC-; 3′ -GTAGTCTCGTCCCAATCCAA-, 扩增片段长度568bp。
1.6 蛋白表达的测定单克隆抗体免疫荧光标记, FACScan流式细胞仪检测蛋白表达的变化。单细胞悬液(1×106个细胞), 75 %冷乙醇固定24 h, PBS洗2次, 1200 r.min-1离心5 min, 除去乙醇。每份样品加入第一抗体p16单抗(鼠IgG, Santa Cruz, 美国)或CyclinD多克隆抗体(Santa Cruz, 美国)或CDK4多克隆抗体(Santa Cruz, 美国)50 μl(1: 50稀释), 4 ℃反应45 min, PBS洗2次, 加第二抗体(Goat anti-mouse IgG-FITC, Santa Cruz, 美国)50 μl(1 : 100稀释), 4 ℃反应45 min, PBS洗2次, 加PBS 500 μl, 流式细胞仪检测。每一样品均设非特异对照, 即用PBS代替第一抗体, 其余步骤同上。用FACScan软件收集细胞, Lysis软件分析数据, 结果以阳性细胞百分率表示。抗体均为用前新配制。
1.7 统计学分析采用student' s t检验方法进行统计学分析。
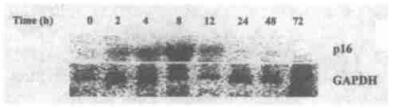
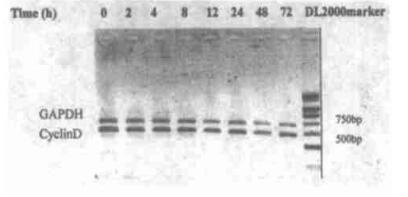
2 结果 2.1 2 Gy X射线照射后脾细胞p16、CyclinD、CDK4基因转录的时程变化2Gy X射线全身照射后2 ~ 72 h, 脾细胞p16、CyclinD和CDK4 mRNA水平的变化见图 2。p16和CDK4采用Northern blot检测(图 3), CyclinD采用半定量RT-PCR方法检测(图 4)。从图 2中可见, 假照射组小鼠脾细胞p16mRNA水平很低, 2 Gy照射后2 h, p16mRNA水平开始增高, 8 h增至最高水平, 为假照射组的2.60倍。24 h恢复至正常水平。CyclinD mRNA水平轻度降低, 于照射后72 h恢复近假照射组水平。照射后2 ~ 72 h脾细胞CDK4 mRNA水平呈降低趋势, 72 h降至最低值, 为假照射组的55.9 %。

|
图 2 2Gy X射线照射后脾细胞p16、CyclinD、CDK4mRNA水平的变化 |
|
图 3 2Gy照射后脾细胞p16 mRNA水平的变化(Northern blot杂交图) |
|
图 4 2.0Gy照射后脾细胞CyclinD mRNA水平的变化(RT-PCR电泳图) |
由表 1可见, 2 Gy X射线照后24h脾细胞内p16蛋白表达显著增多(P < 0.05), 48 h恢复至正常水平; 细胞周期蛋白CyclinD表达未见显著改变; CDK4蛋白表达在照后8 h明显降低(P < 0.05), 48 h降至最低(P < 0.01), 仅为假照射组的29 %, 72 h仍明显低于正常水平。
|
|
表 1 2Gy X射线照射后脾细胞p16、CyclinD、CDK4蛋白表达的变化(x±s) (%) |
在正常细胞增殖过程中, CDK4/6与CyclinD结合激活CDK4/6, 使之具有蛋白激酶活性, 作用于Rb蛋白使其磷酸化, 释放转录因子E2F。E2F能活化DNA聚合酶(POL)、胸苷激酶(TK)、二氢叶酸还原酶(DHFR)等与DNA合成密切相关的重要酶类基因转录, 实现G1→S期转换。而p16通过与CyclinD竟争性结合G1期激酶CDK4/CDK6来抑制其对pRb的磷酸化作用[3, 4], 使游离的E2F-1与未磷酸化的pRb结合, 依赖于E2F-1转录的基因不能转录, 间接抑制包括DNA合成在内的多种生化反应, 从而抑制细胞周期进程。p16在正常细胞中起负反馈作用, 当Rb磷酸化而失活时, p16可使CDK4表达下降, 当细胞Rb蛋白量下降时, 伴随p16表达水平上升, 结果抑制CDK4, 推测p16在Rb基因上游起负反馈作用, 从而影响Rb基因在细胞增殖中的调节作用。结合细胞周期的研究[5], 发现在G1→S转化过程中, 活化的CyclinD-CDK4复合物渐趋失活, 而p16在此时表达到达顶峰, 进入S期过程中, pRb由于磷酸化失活, 失活的pRb一方面促进细胞进入S期, 另外, pRb通过转录因子E2F, 促进p16的转录, 反过来又抑制CyclinD-CDK4激酶中间的反馈作用, 而达到对细胞从G1期到S期转变过程的调控。p16通过p16-CyclinD-CDK4/6-pRb通路调控细胞停滞在G1期。
研究发现在人和鼠发育早期p16表达很低, 但在衰老、紧张因素、理化刺激中表达增加。Ramsamooj[6]首次报道体外培养的正常前列腺细胞在电离辐射(6Gy)照后p16、pRb蛋白水平未见明显改变, 而前列腺肿瘤细胞受照后p16与p21并行性增加, pRb未见明显改变。Suzuki等人[7]发现X射线照后诱导正常人二倍体细胞发生永久性衰老型生长阻滞, 阻滞细胞中可见p53、p21、p16增多。Piepkorn等人[8]用亚致死剂量范围的UVB照射体外培养的人正常黑色素细胞, 采用Western blot和Northern blot方法分别检测p16 mRNA水平和蛋白水平变化。结果发现与假照射组相比, UVB照射后p16蛋白表达显著增加, p16的mRNA水平亦随照射剂量增加而增加。提示p16可介导黑色素细胞发生生长阻滞, 这一短暂的生长阻滞可在细胞进入分裂前修复UVB诱导的DNA损伤。作者近期研究结果发现正常小鼠胸腺(另文报道)和脾脏细胞p16基因转录水平均很低, 2 Gy X射线照射后能够诱导p16mRNA水平提高, 并呈现一定的细胞异质性。
CyclinD是周期素家族的重要成员, 与CDK4形成CyclinD-CDK4复合物, 调节细胞周期的正向进程。大量文献报道各种因素引起DNA损伤时, CyclinD和CDK4二者功能下调[9, 10]。本实验表明2Gy X射线全身照射后可诱导小鼠脾细胞CDK4 mRNA水平和蛋白表达降低, 但CyclinD表达未见明显改变。在p16与CyclinD竞争性与CDK4结合过程中, p16与CDK4的亲和力远大于CyclinD与CDK4的亲和力, 加上照射后p16数量增多。p16-CDK4复合物占据优势, 发挥其负向调控作用, 使Rb蛋白无法与CyclinD-CDK4复合物结合而处于非磷酸化状态, 细胞停滞在G1期。提示: p16/CyclinD/CDK4负向调控通路在电离辐射诱导的G1期阻滞中发挥重要作用。
| [1] |
Ju GZ, Fu HQ, Fu SB, et al. G1 Arrest and relative protein expressions in mousethymocytes induced by WBI[J]. Biomed Enveron Sci, 2001, 14: 27-31. |
| [2] |
傅海青, 鞠桂芝, 罗灿, 等. P21在电离辐射诱导EL-4细胞G1期阻滞中的作用[J]. 中华放射医学与防护杂志, 2000, 20(60): 385-387. |
| [3] |
Shapiro GI, Edwards CD, Rollins BJ. The physiology of p16 (INK4A) -mediated G1 proliferative arrest[J]. Cell Biochem Biophys, 2000, 33: 189-197. DOI:10.1385/CBB:33:2:189 |
| [4] |
Serrano M, Hannon GJ, Beach D. A new regulatory motif in cellcycle control causing specific inhibition of CyclinD CDK4[J]. Nature, 1993, 366: 704-707. DOI:10.1038/366704a0 |
| [5] |
Tam SW, Shay JW, Pagano M. Differential expression and cell cycle regulation of the Cy clinDependent kinase 4 inhibitor p16INK4[J]. Cancer Res, 1994, 54: 5816-5820. |
| [6] |
Ramsamooj P, Kuettel M, Dritschilo A, et al. p53-Independent tumorigenic progression of human prostate cells[J]. Radiat Oncol Investig, 1997, 5: 269-274. DOI:10.1002/(ISSN)1520-6823 |
| [7] |
Suzuki K, Mori I, Nakayama Y, et al. Radiation-induced senescence-like growth arrest requires TP53 function but not telomere shortening[J]. Radiat Res, 2001, 155(1 pt 2): 248-253. |
| [8] |
Piepkorn M. The express of p16 (INK4a), the product of a tumor suppressor gene for melanoma, is upregulated in human melanocytes by UVB irradiation[J]. J Am Acad Dermatol, 2000, 42: 741-745. DOI:10.1067/mjd.2000.103988 |
| [9] |
Miyakawa Y, Matsushime H. Rapid downregulation of CyclinD1 mRNA and protein levels by ultraviolet irradiation in murine macrophage cells[J]. Biochem Biophys Res Commun, 2001, 284(1): 71-76. DOI:10.1006/bbrc.2001.4950 |
| [10] |
Poon RY, Jiang W, Toyoshima H, Hunter T. Cyclin-dependent kinases are inactivated by a combination of p21 and Thr-14 Tyr-15 phosphorylation after UV-induced DNA damage[J]. J Biol Chem, 1996, 271(22): 13283-13291. DOI:10.1074/jbc.271.22.13283 |