2. 中国疾控中心辐射安全所, 北京 100088;
3. 美国国际流行病研究所;
4. 辽宁省疾控中心, 沈阳 110005;
5. 中国卫生部, 北京 100044
矿工研究表明,吸入高浓度的氡-222会增加肺癌危险度[1]。氡在居住环境中无处不在, 虽然浓度远低于矿井,但人们还是关心居室水平的氡对普通人群的肺癌危险度有无影响。利用矿工模型的外推表明, 氡是第二位导致肺癌的因素,德国7%的肺癌[2],荷兰4%的肺癌[3],瑞典20%的肺癌[3]以及美国10% ~ 15%的肺癌[1, 4]是由氡暴露引起的。为了评价这些估计的可靠性,在许多国家进行了居室水平氡与肺癌关系的流行病学研究。
要证实居室水平氡导致肺癌的附加危险度,难度很大。因为预期的附加肺癌危险度很小,并且估算肺癌确诊前多年的氡暴露量不确定度很大[5, 6]。用现在进行的测量表示过去的氡浓度,由于房屋结构变化, 房屋用途变化,生活习惯变化等,都会引起氡浓度的改变, 从而会增加不确定度。所以需要研究具有准确氡暴露量的大量调查对象。
把已经发表的结果进行综合分析(meta-analysis)和把多项研究数据放在一起进行汇总分析(pooling analysis), 可克服样本量的局限问题。关于居室氡与肺癌关系的流行病学研究,单独一项提供的危险度增加证据,由于样本量所限,可能模棱两可,但综合分析就能给出统计明显的居室氡导致肺癌的附加危险度[7, 8]。已经有过一些专题讨论对汇总研究给以指导[9~12]。作为这些努力的第一步,最近完成了对北美七项氡研究的汇总分析[13, 14], 表明氡暴露会使肺癌危险度增加。
中国现有两项涉及居室氡与肺癌关系的病例-对照研究,一项在沈阳, 另一项在甘肃平凉、庆阳地区[17]。后者为农业地区,进行了为期1 a的室内氡测量, 并逐个访问了调查对象,获得了大量数据。本文是把这两项研究的原始数据放在一起进行分析。
1 材料和方法与最近其他研究[13, 18]—样, 假定与肺癌有关的暴露时段(ETW), 对病例为确诊前的5 ~ 30 a, 对对照为访问前的5 ~ 30 a。只对暴露时段内的氡暴露进行评价。矿工分析指出,肺癌确诊前5 ~ 30 a的氡暴露量对肺癌危险度的影响最大[1, 18]。
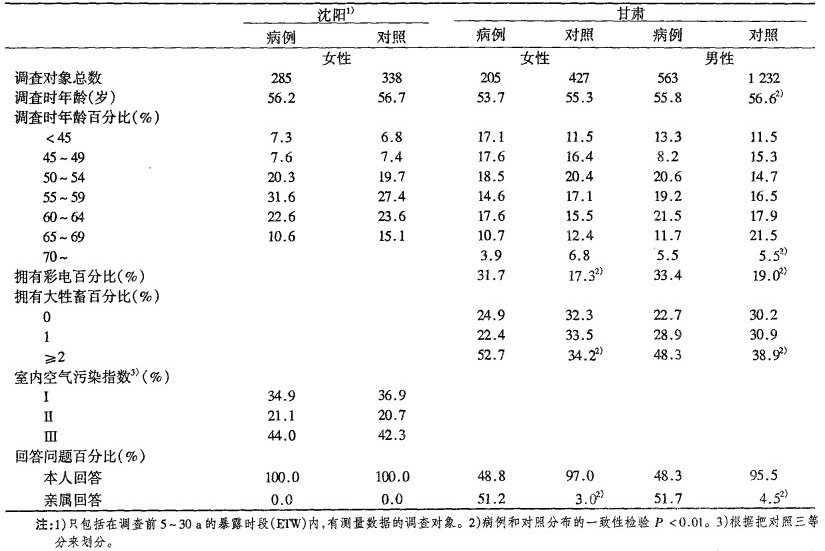
1.1 沈阳病例-对照研究沈阳研究包括了在1985年9月到1987年9月期间诊断、并被沈阳癌症管理机构登记的所有肺癌病例[15, 16]。几乎所有病例都在诊断后一个月内进行了访问。只有5%的病例由于病重或死亡而排除在外。专家组审阅了全部诊断材料。对照从普通人群中随机选取,并在性别和年龄方面与病例匹配。病例共访问了520名女性和729名男性, 对照共访问了557名女性和788名男性。沈阳研究中,氡的部分只涉及课题开始六个月后找到的女性。所以只对78%的合格病例(397名中的308名)和91 %的合格对照(391名中的356名)进行了氡的测量。现在的分析只涉及301名病例和355名对照的数据。现在尚未查出造成调査对象数量减少的原因。
只对每位调査对象的一处住所进行氡的测量。在现住址居住5 a以上的房间,布放2个a径迹探测器,测期1a:一个在卧室,一个在起居室。如果此条件不能满足,则在调查对象居住5 a以上、位于沈阳的过去住所布放探测器。调查对象在测量房间居住的中值年数为24 a。95%的调査对象都得到了两个测量数据。用两个数据的平均值进行分析,如果没有两个数据, 则用一个数据。我们排除了两个调査对象(对照)异常高的数据(1 219, 1 659 Bq/m3), 它们比其余数据最大值要高出50%以上。
原来的分析并没有计算暴露时段内的氡浓度。在此次汇总分析中,才计算了5~30 a暴露时段内的时间加权平均氡浓度(TWA)。但是没有考虑16名病例(平均91.9 Bq/m3)和13名对照(平均61.6 Bq/m3)的数据,因为他们在测量住所内的居住期正好为5 a, 不在暴露时段之内。这样, 只剩下285名病例和338名对照。在暴露时段中没有测量值的年份, 计算时间加权氡浓度时,用对照住所平均氡浓度代替, 这是一种具有较少弊病的公正方法[19]。
1.2 甘肃病例-对照研究甘肃研究包括在1994年1月到1998年4月,在平凉、庆阳地区发现的所有肺癌病例[17]。当地居民大部分都住在独特的窑洞中,室内氡浓度比较高[20]。调査员通过所有相关的医疗机构发现病例。专家评审组审阅所有诊断资料。调査员共访问了886名肺癌病例(656名男性, 230名女性)。因有464名病例(占52.4%)访问时已经死亡,所以只能访问最近亲属。从1990年人口调查资料中随机选取对照,对照要在1與5年时的年龄,性别和地区方面与预期的病例相匹配,预期病例是根据1991年的预调査确定的。共确定1765名对照个体(455名女性,1 310男性)。因为有71名对照访问时已经死亡(占4%),所以访问的是最近亲属。
对每个调查对象而言,从确定为调査对象时起的过去30 a中,凡住过两年以上、位于两个地区的房间都要布放α径迹探测器(一个在起居室,一个在卧室)。在前5 ~ 30 a的暴露时段内, 88%的病例(881名中的775名)和95%的对照(1 765名中的1 669名)至少有一个测量数据。
在计算时间加权氡浓度时,用相同地区对照的同类结构房屋中的平均氡浓度来代替未测年份的浓度[19]。
1.3 统计分析用标准逻辑回归,计算比值比(OR和95%置信度(CI)。沈阳数据,对年龄和三类空气污染指数[15]进行了调整分析。甘肃数据, 对年龄、居住地区、性别和社会经济因素进行了调整。社会经济因素按是否拥有彩电(两级)和大牲畜数(三级; 0,1, ≥2)来划分[17]。与一般研究一样进行年龄组划分(7级:< 45, 45~49, 50~54, 55~59, 60~64, 65~69及≥70岁)。把吸烟量(4级:吸烟史≥40 a,每日吸烟≥20支;吸烟史≥30 a,每日吸烟≥10支;其他吸烟;不吸烟)作为最大危害因素对两项研究进行了调整。再进一步把汇总OR对每项研究进行调整。在排除没有数据的调查对象后,沈阳研究还剩275名病例和333名对照,甘肃研究还剩753名病例和1 641名对照
拟合了一个线性附加比值比(EOR模型:OR=1 +βx, 这里x为时间加权平均氛浓度, β为每Bq/m3的EOR值。还计算了95%置信区间(CI)。通过拟合类别比EOR,1+βjxj, 来估计其他因素引起氡效应的变化(效应修正)。这里xj为氡浓度,βj为在j水平下每Bq/m3的EOR, 用可能性比值检验。初步分析表明,暴露时段的覆盖面与居民迁移率可能是干扰变量。在对照中,与全部覆盖的相比,覆盖面小的个体,迁移率高的个体,氡水平较高。所以又针对不同暴露时段(1, 2, ≥3个住处)的迁移率和覆盖面(< 20, 20~24, ≥25 a)对EOR模型进行了另外的调整。
此次的研究结果与以往公布的略有不同,这是由于对调整因子的分类不同造成的。
2 结果沈阳研究的调査对象, 访问时病例和对照年龄相近,室内污染暴露水平相近(表 1)。而甘肃研究, 病例略为年轻,死亡较多,拥有彩电的较多而大牲畜数较少。年龄差异是由于根据1995年时的年龄选择的对照,而病例的登记周期又扩展了的缘故。年龄差异对结果并无影响, 因为分析中已对年龄进行了调整。
|
|
表 1 两项中国研究中的肺癌病例和对照数目以及人口资料情况 |
在对照群体中,甘肃研究几乎全部男性都吸烟(91 %), 女性吸烟很少(9.8%)。沈阳研究,女性有36.8%吸烟(表 2)。在吸烟人群中,一般都是轻度吸烟。平均每日吸烟支数和吸烟年数分别为:甘肃男性10.7支/d和30.2 a,甘肃女性5• 4支/d和22.1 a, 沈阳女性17.3支/d和34.7 a。对沈阳女性和甘肃男性而言,吸烟会使OR值增加。
|
|
表 2 中国沈阳和甘肃居室氡研究中的调查对象数目,肺癌比值比1)(OR)和吸烟危险度变化 |
数据表明沈阳女性要比甘肃女性迁移率高。在5~ 30 a的暴露时段内, 沈阳女性平均有住所2.0个,每入进行过一次测量;甘肃的男、女调查对象平均有住所1.7个,每人进行过1.2次测量。沈阳研究的病例和对照,氡测量覆盖面分别为暴露时段的67.2%和67.7%;甘肃研究的病例和对照,氡测量覆盖面分别为暴露时段的71.8%和79.1%。氡的算术平均值、几何平均值和几何标准偏差,沈阳的所有探测器分别是115.7 Bq/ra3, 91.2 Bq/m3, 和1.93 Bq/m3; 甘肃的所有探测器分别是222.9 Bq/m3, 176.2 Bq/m3和2.08 Bq/m3。测量值超过150 Bq/m3的探测器甘肃占68.7%,沈阳占17.4%。病例和对照的时间加权平均氡浓度算术平局值,沈阳分别为122.1 Bq/m3, 122.7 Bq/m3; 甘肃分别为232.3 Bq/m3和22.7 Bq/m3。
在甘肃研究中,肺癌的OR值一般随氡浓度的升髙而增加,而沈阳研究,OR值接近1,没有变化趋势(表 3)。
|
|
表 3 在调查前5~30 a的暴露时段(ETW)内,时间加权平均氡氡度对肺癌比值比1)(OR)的影响 |
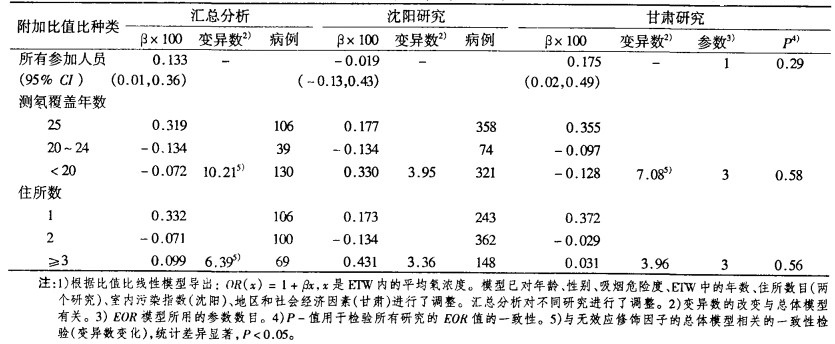
把数据汇总进行分析,在95% CI情况下,在100 Bq/m3处的EOR值为0.133(0.01, 0.36)(表 4)。甘肃数据EOR侃很显著,为0.175(0.02, 0.49), 沈阳数据,虽然并不排除EOR的一致性(P = 0.29), 但EOR值为-0.019(-0.13, 0.43)。图 1中的A图标出了两个研究的OR值和汇总分析的线性OR模型。
|
|
表 4 对所有被调查人员及在调查前5~30a暴露时段(ETW)内,按氡测量年数和居民迁移划分的附加比值比(EOR) |
表 4根据暴露时段的覆盖面和居室数目给出了EOR值。沈阳研究,对测量完全覆盖暴露时段的调査对象(或在暴露时段内仅有一个住所),EOR值是增加的,但不显著,为0.177 (-0.12, 2.04)。对覆盖面小于20 a和有3处以上住所的调査对象,EOR值分别为0.330(- 0.16, ∞)和0.431(- 0_ 16, ∞)。由于覆盖面平均不到9 a, 所以平均16 a的时间加权平均氡浓度只能用单一的推导值。在甘肃研究中, 对完全覆盖的调査对象,或在暴露时段内只有一个住所的调査对象,EOR值有明显升高, 分别为0.355(0.09, 1.08)和0.372(0.08, 1.28)。在汇总数据分析中,根据测量覆盖面和住所数目的不同,EOR值有区别。对完全覆盖的调査对象,EOR值为0.319(0.09, 0.88), 对只有一个住所的调査对象为0.332(0.08, 0.96)。所有研究的EOR型式都相同。

|
图 1 沈阳、甘肃病例-对照研究不同氡浓度时的肺癌比值比(OR)与汇总分析的比值比拟合线性模型(实线)与95%置信限。给出了对所有调查对象的分析结果(A图)和覆盖全部5 ~ 30 a暴露时段并只有一处住所调查对象的结果(B图)。每个OR点是按该组平均氡浓度标出的。 |
具有完全的测量覆盖面和在暴露时段内只有一个住所的调査对象,其接受的氡剂量最为准确。针对这些调査对象,在把氡浓度分类为 < 100, 100 ~149, 150 ~ 199, 200 ~ 249, 250 ~ 299, ≥300 Bq/m3的情况下,沈阳研究的OR值和95% CI分别为1.00, 1.50(0.8, 2.9), 1.21(0.3, 5.2), 2.43(0.6, 10.0),和1.39(0.5, 4.5)(由于调査对象太少,合并了前两组数据)。甘肃研究的OR值和95% CI分别为1.00, 0.99(0.6, 1.8), 1.34 (0.8, 2.4), 1.37(0.8, 2.4), 0.89(0.46, 1.74)和1.91(1.1, 3.3)。对汇总数据,OR值和95% CI分别为1_00, 1.18(0.8, 1.8),1.44(0.9, 2.3), 1.53(0.9, 2.5),1.05(0.6, 1.9)和1.93(1.2, 3.1), EOR值为0.315(0.07, 0.91)。图 1中的B图标出了这些数据的OR值和EOR值。
还对所有调査对象、对具有完全测量覆盖面的调查对象、以及对在暴露时段内只有一个住所的调査对象, 按性别、室内烟雾、吸烟状况分类进行氡引起EOR值的估计, 发现没有明显变化。只有对是否由被访者本人回答问题,EOR值才有显著差别:调査对象本人回答问题和由代理人回答问题,在100 Bq/ m3处的EOR值分别为0.086和-0.090(P =0.01),对具有完全测量植盖面的调査对象,此值分别为0.382和-0.096(P = 0.01)。
3 讨论两项中国氡研究的汇总分析表明,居室水平氡浓度的增加会产生肺癌的附加危险度。对这些数据进行处理表明, 改进了的暴露量评价会增加附加危险度的估计值。在100 Bq/m3处的EOR值会从全部数据的0.133(0.01, 0.36)增加到全部覆盖及在暴露时段内只一处住所调查对象的0.315(0.07, 0.91)。这些EOR值与北美氡研究的汇总分析估计一致,即具有长期剂量测量的调査对象为0.106(0.00, 0.28), 对具有完全测量覆盖面的调查对象为0.205(0.03, 0.50)[14]。此EOR值与根据矿工数据的外推结果类似, 矿工外推值在100 Bq/m3处的EOR值为0.117[1]。
EOR随其他因素变化的评价结果与北美数据汇总分析类似[14]。北美和中国的汇总分析发现,对非吸烟者和吸烟者EOR值相似, 且年龄没有显著影响。这两个分析与矿工研究有差别,矿工研究中,吸烟者和诊断年龄较大的人,暴露-响应明显偏低[1, 14]。还没有探讨造成这些差别的原因,但可能与下述因素有关:矿工受到了较高的暴露,退休后引起职业肺癌危险度的因素和肺部刺激(如砷和硅的粉尘)的突然停止,或没有完全掌握停止氡暴露或停止吸烟产生的效应。
中国和北美的汇总分析,已经接近证明男性和女性居室氡暴露会引起EOR的增加。此结果对公众氡暴露危险度评价有重要意义。估算居室水平氡对肺癌危险度的贡献,现在的做法是,假定肺癌发病率与氡暴露量之间的线性比例关系, 一直保持到本底肺癌发病率,并且矿工危险度模型对男性和女性都适用。与此相对的是氡效应相加转移假设, 即男性的氡致肺癌危险度相加到女性的肺癌危险度之上[21, 22]。中国、北美的汇总分析为支持比例假设提供了经验证据,氡产生的危险度对男性和女性相同。
由调査对象本人提供资料,可观察到肯定的EOR, 而由调查对象亲属提供的资料, 却不能。氡暴露是一种待测物理ft, 不应受调査对象生命状态的影响。由于提供资料的人员不同产生的差别, 可能与资料的准确程度有关,亲属提供的资料不确定度大,导致这一子群体的偏离趋向零。在北美汇总分析中也发现了类似的变化。
对沈阳数据的分析也表明了氡暴露的正危险度模式,但并不显著, 特别是对特定范围的数据更是如此。这与原分析有差别,原分析认为没有证据表明氡会引起附加肺癌危险度[15]。产生这种差别可能有几种原因。现在分析采用的剂量是用调査前5 ~ 30 a暴露时段内,用对照探测器的平均值,来填补未测量的缺口,而原来用的测氡剂量,没有考虑居住时间长度。对肺癌这样的非常见病并假定遗漏没有影响,数据填补法不会带来偏差[19]。原来的剂量是把测量的氡与在暴露时段内没测量的房间等同看待。采用单一值来估计整个暴露段内的氡浓度会增加传统误差,因而会导致零向偏离结果[23, 24]。
其次,在暴露时段内, 病例和对照氡测量的平均覆盖面相同;但是病例的覆盖面与氡水平正相关,而对照则几乎不相关。因而,对于对照,从原始测量得到的暴露时段内的暴露量,对各种覆盖面的调整值都相同,与浓度无关。在病例情况下,具有较低覆盖面的病例有较低的氡水平,所以在暴露时段暴露量计算的填补中影响也不相同。在最初的分析中没有考虑覆盖面造成的潜在干扰。
在沈阳数据的分析中, 排除了两个对照数据,因为他们的氡测量值要比其余最大值高出50%以上,但除了数值异常外, 尚未发现数值有错误。但调查对象有影响。包括与不包括这两个极端浓度,会使EOR值从-0.060变化到0.019。对于测量完全覆盖暴露时段的调查对象,包括与不包括这两个极端浓度,会使EOR值从0.020变化到0.177。值得注意的是,如果排除浓度高于300 Bq/m3的20个调査对象(表 4中数据第一行), 或限定数据中的W个调查对象,则前者EOR值为-0.010, 后者为0.935。如果包括沈阳的两个异常暴露数据,对两项研究的所有调査对象,汇总分析的EOR值要由0.133(0.01, 0.36)降到0.102(-0.01, 0.31), 但对于完全覆盖和只有一个住所的调査对象,值只从0.315(0.07, 0.91)降到0.278 (0.06, 0.82)。
总之,对在中国不同地区(一个在农村,一个在城市)的两项研究进行汇总分析,表明对EOR值的估计与对北美和欧洲研究的分析结果相同,与矿工的推导一致。这些分析提供了更多的直接证据,表明居室水平的氡浓度会使普通人群的肺癌危险度增加。
| [1] |
National Research Council. Health efFects of exposure to radon (BEIR VI)[M]. Washington, DC: National Academy Press, 1999.
|
| [2] |
Steindorf K, Lubin J.Wiclimarm HE, et al. Lung cancer deaths attributable to indoor radon exposure in West Germany[J]. Int J Epidemiol, 1995, 24: 485-92. DOI:10.1093/ije/24.3.485 |
| [3] |
Leenhouts HP, Brugmans MJP. Calculation of the 1995 lung cancer incidence in the Netherlands and Sweden caused by smoking and radon:risk implications for radon[J]. Radiation and Environmental Biophysics, 2001, 40: 11-21. DOI:10.1007/s004110000084 |
| [4] |
Lubin JH, Tomasek L, Edling G, et al. Estimating lung cancer mortality from residential radon using data for low exposures of miners[J]. Radiat Res, 1997, 147: 126-34. DOI:10.2307/3579412 |
| [5] |
Lubin JH, Samet JM, Weinberg G. Design issues in epidemiologic studies of indoor exposure to Rn and risk of lung cancer[J]. Health Phys, 1990, 59: 807-17. DOI:10.1097/00004032-199012000-00004 |
| [6] |
Lubin JH, Boice JD, Jr., Samet JM.Errors in exposure assessment, statistical power and the interpretation of residential radon studies[j].Radial Res, 1995, 144: 329-41.
|
| [7] |
Lutin JH, Boice JD, J r. Lung cancer risk from residential radon:meta-analysis of eight epidemiologic studies[J]. J Natl Cancer Inst, 1997, 89: 49-57. DOI:10.1093/jnci/89.1.49 |
| [8] |
Lubin JH. Indoor radon and risk of lung cancer[J]. Radiat Res, 1999, 151: 105-7. |
| [9] |
U.S.Environmental Protection Agency OflGce of Energy Research, Commission of European Communities Radiation Protection Programme.International worksltop on residential radon epx-demiology[R].CONF-8907178.SpringCeld, Virginia 22161, National Technical Information Service, U.S.Department of Commerce.1989.
|
| [10] |
U.S.Environmental Protection Agency Office of Energy Research, Commission of European immunities Radiation Protection Programme.Report on the second international workshop on residential radon[R].CONF-9107220.Springfield, Viipnia 22161, National Technical Information Service, U.S.Department of Commerce.1991.
|
| [11] |
U, S.Environmental Protection Agency Office of Energy Research, Commission of European Communities Radiation Protection Programme.TTiird International DOE/CEC Residential Radon Epidemiology Workshop February 1995[R].DOE/ER-0668.Springfield, Vii.iiiia 22161, National Technical Infor mation Service, U.S.Department of Commerce.1995.
|
| [12] |
Simonato L, Agudo A, Ahrens W. Lung cancer and cigarette smoking in Europe:An update of risk estimates and an assessment of inter-country heterogeneity[J]. International Journal of Cancer, 2001, 91: 876-87. DOI:10.1002/(ISSN)1097-0215 |
| [13] |
Krewski D, Lubin JH, Zielinski JM, et al.Risk of lung cancer in North America associated with residential radon[Z].Submitted.
|
| [14] |
Krewski D, Lubin JH'Zielinski JM'et al.A combined analysis of North American case-control studies of residential radon and lung cancer[J].Journal of Toxicology and Environmental Health 2003(To apear).
|
| [15] |
Blot WJ, Xu ZY, Boice JD, Jr.et al.Indoor radon and lung cancer in China[j].J Natl Cancer Inst, 1990, 82: 1025-30.
|
| [16] |
Xu ZY, Blot WJ, Xiao HP, et al. Smoking, air-pollution, and the high rates of lung cancer in Shenyang, China[J]. Journal of the National Cancer Institute, 1989, 81: 1800-6. DOI:10.1093/jnci/81.23.1800 |
| [17] |
Wang ZY, Lubin JH, Wang LD, et al.Residential radon and lung cancer in a high exposure area in Gansu Province, China[j].Am J Epidemiol, 2002*155: 554-64.
|
| [18] |
Darby S, Hill D.Health effects of residential radon: a European perspective at the end of 2002[j].Radiat Prot Dosim, 2003.
|
| [19] |
Weinberg CR, Moledor E5, Umbach DM, et al. imputation for exposure histories with gaps, under an excess relative risk model[J]. Epidemiology, 1996, 7: 490-7. DOI:10.1097/00001648-199609000-00007 |
| [20] |
Wang ZY, Lubin JH, Wang LD, et al. Radon measurements in underground dwellings from two prefectures in China[J]. Health Phys, 1996, 70: 192-8. DOI:10.1097/00004032-199602000-00006 |
| [21] |
International Commission on Radiological Protection.Lung cancer risk from indoor exposures to radon daughters[M].Oxford, England, Pergamon Press.1987.
|
| [22] |
National Council on Radiation Protection and Measurements (NCRP).Exposures from the uranium series with emphasis on radon and its daughters[R].NCRP Report 77.Washington, D.C., National Council on Radiation Protection and Measurements.1984.
|
| [23] |
Reeves GK, Cox DR, Darby SC, et al. Some aspects of measurement error in explanatory variables for continuous and binary regression models[J]. Staf Med, 1998, 17: 2157-77. DOI:10.1002/(ISSN)1097-0258 |
| [24] |
Darby S, Whitley E, Silcocks P, et al.Risk of lung cancer as-SiX.iated witli residential radon exposure in Southwest England: a case-control study[l].Br J Cancer, 1998, 78: 394-408.
|



 ,
,