在度量电离辐射所引起的生物机体量效关系和评估危害程度的方法中, 染色体畸变分析应用最早、发展最为成熟, 广泛应用于辐射效应研究。染色体断裂点是照后容易检测的指标, 因此在许多研究中成为生物剂量估算的依据。但是由于目前细胞遗传学研究手段的制约, 通常只能对几个染色体进行分析, 然后根据所得的结果外推至整个基因组。如果这个过程可行的话, 必须假定所分析的染色体能够代表整个基因组, 也就是说辐射诱导的染色体断裂在整个基因组是随机分布的, 即主要依赖DNA含量。G显带方法能较准确地对染色体各个畸变断裂点加以定位, 判定染色体细微结构的变化。本文应用G显带方法对医用诊断X射线工作者染色体畸变断裂点的分布进行了分析。
1 材料和方法 1.1 实验对象医用诊断X射线工作者37人, 均为男性, 年龄范围38~67岁, 平均55岁, 平均放射工龄28 a, 参加工作的起始年限为1951~1979年。对照组10人, 为相同医院中同时期、同性别、同工作条件、同年龄范围, 但不接触X射线的医务人员。
1.2 细胞培养和制片肝素抗凝的外周血0.5 ml接种在4.5 ml含15%小牛血清、适量抗生素和PHA的RPMI 1640培养基中, 置5% CO2培养50 h, 终止培养前6 h加入终浓度为0.12 μg/ml秋水仙素。终止培养后用0.075 mol/L KCl低渗处理15 min, 甲醇:冰醋酸(3:1)固定, 制片。
1.3 G-显带选择分散良好的中期相标本置60℃干燥箱干燥4 h, 然后用含有EDTA的0.05%胰酶处理, Giemsa染色。
1.4 畸变分析选择带型清楚和分散良好者镜下直接分析, 每例分析约100个中期相(55~100), 有异常或怀疑有异常者显微摄影、剪贴、组型。
1.5 统计处理分析标准按照国际命名体系测定断裂点的分布, 预期值采用Morton[1]所提供的每条染色体的相对长度值计算, 然后对数据进行χ2检验, 分析观察值与预期值差异的显著性。
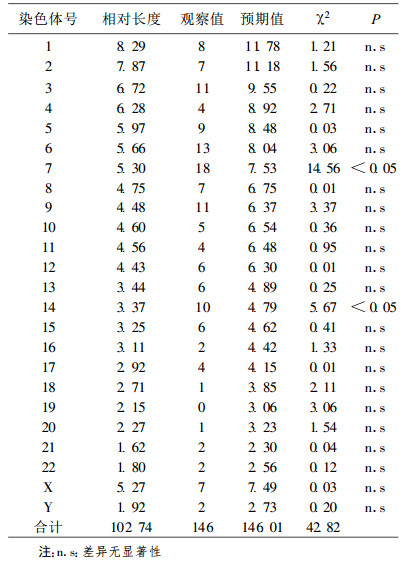
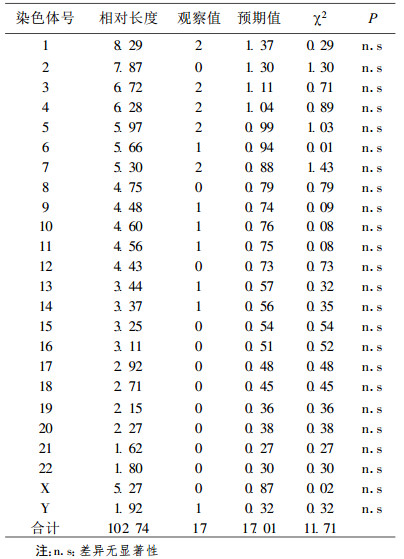
2 结果37名X射线工作者分析G显带中期分裂细胞3 545个, 共有断裂点146个, 其分布见表 1, 统计学处理观察值和预期值有非常显著性差异(χ2=42.82, df=23, P < 0.01), 医用诊断X射线工作者染色体畸变断裂点呈非随机分布。对每条染色体分别加以比较, 发现其中第7和14号染色体的断裂点数目观察值比预期值高(P < 0.05), 在7 p13和14 p11的位点断裂频率较高, 各占其染色体总断裂的16.67%和20%。10名对照人员G显带中期分裂细胞908个, 共有断裂点17个, 其分布见表 2, 未发现断裂点多发的染色体, 统计学处理观察值和预期值差异无显著性(P > 0.05)。
|
|
表 1 X射线工作者断裂点分布的测定 |
|
|
表 2 对照人员断裂点分布的测定 |
多年来, 电离辐射诱导染色体断裂点分布规律进行了大量的研究, 包括经典的细胞遗传学研究(如显带)和分子遗传学研究(如染色体彩染)。本文用G显带方法对医用诊断X射线工作者染色体畸变断裂点进行了分析, 结果表明断裂点分布是非随机的, 这与目前许多研究的结果是一致的。Fernandez等[2]在研究中发现, 健康供体外周血淋巴细胞第1、2号染色体很少发生X射线诱导的互换, 并且与其DNA含量不成比例, Knehr等[3]的研究也得出了相同结论。在本研究中, 经过对每条染色体加以比较, 发现第7和14号染色体的断裂点数目观察值比预期值高, 存在显著性差异(P < 0.05)。说明这两条染色体对辐射的敏感性更强, 而第1、2和4号染色体呈现相反趋势, 染色体的断裂点数目观察值远低于预期值, 这与Cigarran等[4]的研究结果有些吻合。在他们的研究中发现, 低DNA含量的染色体(13~22, 包括Y)有较高的畸变发生倾向, 而高DNA含量的染色体(1~12, 包括X)发生畸变的倾向与其期望值相比偏低。作者认为这可能和每个染色体在核中所占空间不同有关, DNA含量可能不是诱发染色体畸变的唯一相关因子。由表 1中可见, 还有一些染色体畸变观察值与DNA含量不成比例, 如第19号染色体观察值为0, 这可能与分析的细胞中期数太少有关。表 2结果显示了健康对照人员染色体断裂点的分布, 未发现断裂点多发的染色体, 且其观察值与预期值差异无显著性(P > 0.05), 从一定程度上表明X射线与染色体断裂点的发生具有相关性。
目前, 辐射诱导的染色体畸变断裂点分布研究的结果还有些存在矛盾。有些研究认为, 断裂点的分布是随机的[5, 6], 因此这方面研究还应进一步深入。在本研究中, 从整体看, 尽管染色体畸变分布是非随机的, 但对每条染色体分别加以比较后, 发现除第7和14号染色体外, 其他染色体断裂数的观察值与预期值无显著性差异。因此适当选择一些染色体作为观察对象, 以此来代表整个基因组还是可行的, 关键是染色体的选择, 这与Johnson等[7]的结论是一致的。
| [1] |
Morton N.E. Parameters of the human genome[J]. Proc.Natl. Acad.Sci.USA, 1991, 88: 7474. DOI:10.1073/pnas.88.17.7474 |
| [2] |
Fernandez J.L, Campos A, Goyanes V, et al. X-ray biological dosimetry performed by selective painting of human chromosomes 1 and 2[J]. Int J Radiat Biol, 1995, 67: 295. DOI:10.1080/09553009514550351 |
| [3] |
Knehr S, Zrrzelberger H, Braselmann U, et al. Chromosome analysis by fluorescene in situ hybridization:further indications for a non-DNA-proportional involvememnt of single chromosomes in radiation-induced structural aberrations[J]. Int J Radiat Biol, 1996, 70: 385. DOI:10.1080/095530096144851 |
| [4] |
Cigarran S, Barrios L, Barquinero J.F, et al. Relationship between the DNA Content of human chromosomes and their involvement in radiation-induced structural aberrations, analysed by painting[J]. Int J Radiat Biol, 1998, 74: 449. DOI:10.1080/095530098141311 |
| [5] |
Sachs R.K, Kodam Y, Nakano M, et al. Ratios of radiation- produced chromosome aberrations as indicators of large-scale DNA geometry during interphase[J]. Radiation Research, 1993, 133: 345. DOI:10.2307/3578220 |
| [6] |
Lucas J.X, Awa A, Straume T, et al. Rapid translocation frequency analy sis in human decades after exposure to ionizing radiation[J]. Int J Radiat Biol, 1992, 62: 53. DOI:10.1080/09553009214551821 |
| [7] |
Johnson K.L, Brenner D.J, Nath J, et al. Radiation-induced breakpoint mistejoining in human chromosome:random or nonrandom[J]. Int J Radiat Biol, 1999, 75: 131. DOI:10.1080/095530099140582 |