浓缩铀(235U)作为一种核燃料和核武器装料, 在国防装备和能源利用方面有十分重要的应用价值。特别是核电站的不断建立促使低浓缩铀的利用更加迅速发展。伴随而来的是气体扩散厂浓缩铀生产的不断增长。因而有必要研究浓缩铀的毒理学效应, 特别是对CNS的毒理学效应[1]。本实验以丰度为18.9%的235U注入SD大鼠侧脑室, 以β-NGF得率和脑匀浆离心上清蛋白质的变化为观察指标, 研究了浓缩铀(235U)内污染时机体对脑内蛋白组分的影响。从而可为核能利用过程中的辐射防护评价和辐射防护标准制定提供新的依据。
神经生长因子(NGF)是维持交感神经元和感觉神经元细胞存活、生长、发育和分化的必需营养因子。它参与神经系统和免疫系统相互作用的调节, 而且在临床治疗Alzheimer's病和神经退行性病变以及外周神经损伤等疾病中, 具有良好的疗效。但由于NGF是高分子量蛋白, 血脑屏障通透性差, 从而阻碍了对临床治疗的应用。我们考虑到其亚单位β-神经生长因子(β-NGF)的分子量相对较小, 可以部分通过血脑屏障, 具有良好的临床应用前景[2, 3]。为此, 本课题对SD大鼠脑中β-NGF的提取进行了研究。
1 方法 1.1 235U脑内内污染模型的建立选取体重在200±10g范围内的健康雄性SD大鼠喂养48 h后, 随机分组, 实验组设浓缩铀235UO2F2)10μg组、20μg组和30μg组, 同时设相应对照组, 每组5~6只SD大鼠。注射浓度分别为0.6μg/ μl、1.2μ g/ μl、2.4μ g/μl。注射位置为冠状缝后1.5 mm, 矢状缝左侧旁开2 mm, 注射深度为3.5 mm, 垂直进针[4]。注射235UO2F2后的SD大鼠继续饲养48h, 然后颈动脉放血处死, 立即沿矢状缝剪开颅骨, 分离脑膜, 取出完整的大脑, 置于冰生理盐水中漂洗, 然后置于-20℃低温冰箱中备用。
1.2 β-NGF分离纯化CM-32预处理:CM-32加二蒸水搅拌, 自然沉淀, 倾去上清液, 2倍体积1NHCl浸泡30min, 自然沉淀, 倾去上清液, 二蒸水漂洗至中性, 2倍体积1N NaOH浸泡30min, 自然沉淀, 倾去上清液, 二蒸水漂洗至中性, 装柱(2 cm ×25cm用于大鼠脑的分离纯化), 以缓冲液平衡。研究具体方法如下:预冷(0℃)二蒸水15ml加SD大鼠脑10g匀浆, 14 000 rpmx45min约15 000-17 000 g), 0℃离心, 上清对0.02 mol/LpH6.8PB, 4b透析800 mlx6hx6次。经透析的上清过CM-32 (2 cmx25cm)层析柱, 层析柱以0.02mol/LpH6.8PB缓冲液平衡并洗脱, 流速50 ml/h, 收集洗脱峰, 对0.25 mol/L pH6.8PB, 4℃透析800 mlx6hx6次。透析过的收集液加1/9体积0.5mol/L pH4.0 NaAc缓冲液, 迅速降pH值至4.0, 然后加固体NaCl使其终浓度为0.4mol/L, 混匀静置5min后, 14 000 rpmx45min, 0b离心, 离心上清迅速过CM-32柱Ⅱ(2 cmx25 cm)层析柱以含0.4 mol/L NaCl的0.05 mol/L pH4.0的NaAc缓冲液平衡并洗脱, 待第一峰结束后, 换0.05 mol/L pH9.0Tris-HCl洗脱至pH8.0, 迅速换含0.4mol/LNaCl的0.05 mol/LpH9.0的Tris-HCl洗脱, 流速50ml/h, 收集洗脱峰, 分别对0.02 mol/LpH7.0PB, 4b, 800 mlx6hx6次透析, 透析液用聚乙二醇20000浓缩至约2 ml。
1.3 SDS-PAGE鉴定提取物的纯度和分子量以15%的聚丙烯酰胺分离胶, 3.9%的积层胶, 10 mA恒流电泳。标准蛋白分子量范围为14 400~97 400[5]。每组样品设一个提取物泳道, 若干个脑匀浆离心上清梯度稀释泳道。电泳结束后以考马斯亮兰染色, 经脱色后拍照并量取迀移距离。以标准蛋白分子量常用对数为纵坐标, 相对迀移率为横坐标作图。然后确定样品蛋白的分子量。
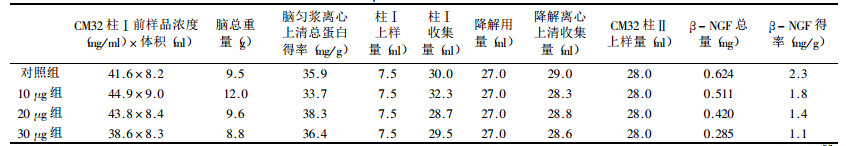
1.4 Lowiy's法定量脑匀浆离心上清总蛋白和p-NGF提取物(表 1)|
|
表 1 Lowry's法测蛋白含量(ml) |
对数生长期PC12细胞以RPMI 1640完全培养液调浓度至2x 106/ml, 1 x 106/孔加入24孔板。每孔加纯化SD大鼠β-NGF 50 ng/ml, 每3d更换培养液, 培养6 d。每孔记数200个细胞, 计算突起生长率, 并拍照。每组设3个复孔。每孔总液量1 ml。
以上实验另设空白对照组, 其细胞仅加RPMI 1640完全培养液。
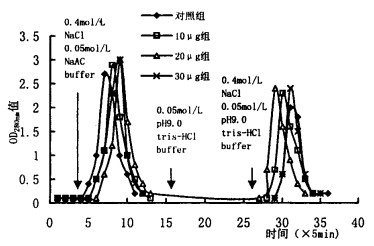
2 结果 2.1 分离纯化SD大鼠脑匀浆上清上样于CM32层析柱Ⅰ, 以0.02 mol/L pH5.8 PB洗脱可得到一个洗脱峰。降解离心上清上样于CM32层析柱Ⅱ, 以含0.4 mol/L NaCl的0.05 mol/L pH4.0 NaAc洗脱可得到一个洗脱峰, 之后以含0.4 mol/L NaCl的0.05 mol/L pH9.0 Tris-HCl洗脱可得到另一个洗脱峰。各组之间相比CM32层析柱Ⅰ和Ⅱ的交换图谱没有显著差(图 1~2)
|
图 1 CM32层析柱Ⅰ交换图谱 |
|
图 2 CM32层析柱Ⅱ交换图谱 |
在对照组实验组CM32层析柱Ⅱ峰2的泳道上均有一单一条带, 分约13 200。各组脑匀浆上清的主要组份如下面各行中所; 见脑匀浆上清中间两个组份的分子量范围可随235U内污量增加而加宽, 30μg组还出现了条带数目的增加。
对照组:12 600, 37 200~42 700, 60 300~72 400, 102 300
10μg组:12 600, 36 300~45 700, 77 600~85 100, 109 600
20μg组:12 600, 35 500~46 800, 57 500~93 300, 109 600
30μg组:12 800, 32 000~37 200, 43 200~56 200, 70 400~102 500, 209 300
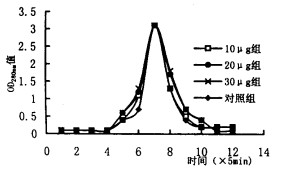
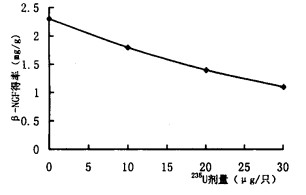
2.3 Lowry's法定量脑匀浆离心上清总蛋白和β-NGF提取物实验结果经校正后, 对照组、10μg组、20μg组、30μg组的β-NGF得率依次为2.3, 1.8, 1.4, 1.1 mg/g(脑匀浆上清总蛋白), 可见随235U内污染剂量的增加, 则β-NGF的得率呈递减趋势, 并呈线性关系(P < 0.01)。(表 2~3, 图 3)。
|
|
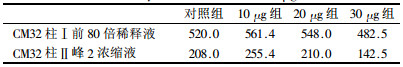
表 2 Lowry's法定量蛋白结果(μg/ml) |
|
|
表 3 β-NGF提取物得率计算 |
|
图 3 235U脑内污染与β-NGF得率的剂量效应关系 |
各组细胞在β-NGF提取物的作用下, 24 h即有细长突起长出, 胞体增大。培养至第3d时, 细胞之间的突起相连或交错成网状。细胞突起生长率在90%左右, 各组间差别无显著性, 见表 4。
|
|
表 4 PC-12细胞突起生长试验的突起生长率 |
本实验研究从SD大鼠脑中提取获得了较高纯度的生物活性良好的β-NGF, 并证实SD大鼠脑!NGF的提取率随235U内污染剂量的增加而降低, 并呈线性关系。值得指出的是, 在CNS中胶质细胞是IL-1有效的生产者, 而IL-1和NGF在脑损伤部位都有积聚, NGF本身是活化的免疫细胞释放的一个过程[6, 7]。因而实验中β-NGF得率降低是235U作用的结果。已证实浓缩铀在新生大鼠脑细胞内主要聚集于细胞核, 并对皮质、海马回等区的蛋白多肽含量有降低作用, 如神经元特异性烯醇化酶(NSE)。而NGF和NGFmRNA在新生大鼠和成年大鼠脑中广泛表达, 其中以海马, 新皮质层和嗅球的浓度最高[8]。通过低温高速离心、离子交换层析、透析等过程, 从人胎脑和SD大鼠脑中分离纯化, 得到了β-NGF, 并经PC12细胞突起生长试验鉴定, 发现β-NGF具有良好的生物活性。进而探讨了浓缩铀(235U)内污染对脑内蛋白组份的作用, 发现浓缩铀内污染机体时, 可以导致β-NGF得率降低, 并与内污染剂量成线性关系, 同时可导致脑内蛋白质裂解, 从而使SDS-PAGE电泳图谱中主要蛋白组份分子量范围扩大、条带增加。研究结果可为放射防护标准的制定和核能利用中的放射卫生防护评价提供依据。
| [1] |
朱寿彭. 浓缩铀的放射毒理[M]. 北京: 原子能出版社, 1998: 1-140.
|
| [2] |
Kessler DS, Melten DA. Vertebrate embryonic induction[J]. Science, 1994, 266(5185): 596-601. DOI:10.1126/science.7939714 |
| [3] |
Rogers BC. Development of recominant human nerve growth factor as a treatment for peripheral neuropathic disease[J]. Neuro-toxicology, 1994, 17(3-4): 865-868. |
| [4] |
朱寿彭, 刘忠浩. 中脑导水管壁及周围灰质和针刺镇痛时的3H-5羟色胺含量变化[J]. 生理学报, 1985, 37(5): 49. |
| [5] |
Spranger M, Lindholm D, Bandtlow C, et al. Regulation of nerve growth factor synthesis in the rat central nervous system:comparison between the effects of interleukin-1 and various growth factors in astrocyte cultures and in vivo[J]. Eur J Neuroscience, 1990, 2: 69-76. DOI:10.1111/ejn.1990.2.issue-1 |
| [6] |
Otten U, Weskamp G, Hardung M, et al. Synthesis and release of nerve growth factor by rat macrophages[J]. Soc Neurosci Abstr, 1987, 13: 84. |
| [7] |
朱寿彭, 李章. 放射毒理学[M]. 北京: 原子能出版社, 1992: 223.
|
| [8] |
Maisonpierre PC, Belluscio L, Squinto S, et al. Neurotrophin-3:A neurotrophic factor related to NGF and BDNF[J]. Science, 1990, 247: 446-1451. DOI:10.1126/science.247.4941.446 |