细胞凋亡是一种程序化死亡过程, 是细胞针对所处环境因素的特定改变所产生的应答, 在机体中承担着重要的调控作用〔1〕。已经观察到γ射线和X射线外照射, 可导致细胞凋亡发生〔2〕。但关于放射性核素内照射诱发细胞凋亡的研究, 有待阐明。作为荧光涂料激发能源和在核辅助动力装置系统中广泛应用的β辐射体核素147Pm, 其对人类和生态环境的污染已引起人们的关注〔3, 4〕。为此, 本文研究了147Pm辐照作用诱发人白血病HL-60细胞的凋亡作用。
1 实验方法 1.1 细胞培养实验用人白血病HL-60细胞株由江苏省血液研究所提供, 由我院细胞免疫中心室传代培养。取HL-60细胞株用RPMI 1640(GIBCO)全培养液中维持培养, 即在RPMI 1640培养液中增补10%灭活小牛血清, 2mmol/L谷氨酰胺, 及100U/ml青霉素, 100μg/ml链霉素, 用NaHCO3调至pH7.2使用〔5〕。实验时, 取指数生长期的HL-60细胞, 先用PBS (pH7.4)液洗涤两次后, 再用全培养液调至实验所需细胞浓度备用。
1.2 细胞受147Pm辐照的累积吸收剂量估算收集实验用HL-60细胞, 用RPMI 1640全培养液调至细胞浓度为2×106 cells/ml。取无菌24孔培养板, 在每培养孔内放置1ml细胞悬液, 然后在每一实验孔中另加入1ml用RPMI 1640全培养液稀释的7.4 ×102 kBq/ml147Pm工作液, 从而使147Pm的最终放射性活度为3.7×102 kBq/ml。而对照组每孔加入1 ml RPMI 1640全培养液, 使实验孔和对照孔细胞最终浓度为1×106 cells/ml。将24孔培养板放置到5% CO2培养器内37℃培养, 在不同时间收集细胞用于细胞凋亡研究。实验中选择的时间观察点分别为3, 6, 9, 12, 24和48h。对HL-60细胞受147Pm辐照不同阶段的累积吸收剂量估算, 参照公式〔6〕D=AE/m。式中, D为细胞的累积吸收剂量, 以mGy计; A为147Pm内照射放射性活度, 以kBq计; E为147Pm的β粒子平均能量, 为0.07MeV; m为受照HL-60细胞质量。由此得出HL-60细胞受不同时期147Pm辐照的累积吸收剂量分别为:40.8mGy/3h, 81.8mGy/6h, 122.8mGy/9h, 163.7mGy/12h, 327.4mGy/24h和654.7mGy/48h。
1.3 透射电镜形态观察收集受147Pm辐照作用不同时间的人白血病HL-60细胞, 洗涤和离心去除游离的放射性核素后, 用3%戊二醛在4℃固定1h, 随后用磷酸盐缓冲液洗涤(pH7.2)二遍, 再用1%锇酸固定1h, 然后用丙酮液梯度脱水, 树脂包埋后, 用LKB型超薄切片机切取0.05μm超薄切片, 并粘贴在预先覆有支持膜的铜网上, 最后经醋酸铀-枸椽酸铅染色, 在透射电镜下观察凋亡HL-60细胞的形态特征。
1.4 DNA的提取取2×106 cells/ml的实验组和对照组的HL-60细胞, 200g离心洗涤后, 细胞在Eppendorf离心管内悬浮于1ml内含10 mmol Tris °HCI (pH8.0)、1mmol EDTA、10mmol NaCl、1% SDS的DNA抽提缓冲液中, 再补充20μg RNAase及100μg蛋白酶K, 用玻棒轻搅使溶液至粘稠状, 置于37℃温箱中12h。待DNA抽提缓冲液冷却至室温后, 加入等容积饱和酚溶液, 温和地上下转动离心管混匀两相, 12000r离心10min, 小心吸出上层粘稠水相, 移至一干净Eppendorf离心管内, 加入等体积饱和酚溶液再抽提一次。然后再用1:1的氯仿:酚溶液抽提一次后, 将上层水相移入一新Eppendorf管内, 加入0.3 mol乙酸钠-乙醇溶液沉淀DNA, 轻轻反复翻转离心管后, 准确加入2倍容积的冰冷无水乙醇置冰格中30min, 随即在4℃的12000r离心10min收取DNA, 弃去无水乙醇后, 用70%乙醇混匀漂洗3次, 开盖, 室温放置15min让乙醇挥发, 加入1mmol EDTA、10 mmol Tris °HCl (pH7.8) TE缓冲液, 使DNA溶解, 置4℃冷藏。
1.5 DNA琼脂糖凝胶电泳取10μl提取的DNA样品(含1μg DNA量)与0.25%溴酚兰和40%蔗糖溶液混匀后, 加入琼脂糖凝胶样品槽内, 在由1mmol/L EDTA (pH8.0)和45mmol/L Tris-硼酸缓冲液配制的内含0.5μg/ml溴乙锭染料的1.5%琼脂糖凝胶中电泳〔7〕, 电压稳定在50V, 电泳1.5h后, 取出标本在紫外灯下观察DNA阶梯状条带形成的HL-60细胞凋亡特征。
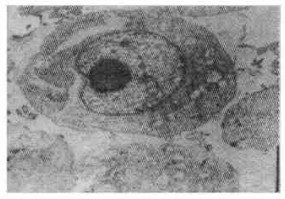
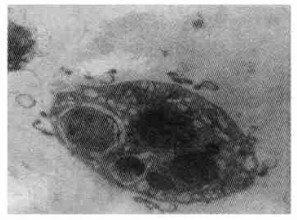
2 实验结果 2.1 147Pm诱发HL-60细胞凋亡的电镜形态特征通过透射电镜的胞核形态观察表明, 正常的HL-60细胞在透射电镜下可见细胞核形正常, 核内染色质呈不均一分布如图 1中所示。而当HL-60细胞受到147Pm辐照作用后, 可呈现出凋亡细胞的形态特征:可见到在受147Pm辐照12h的HL-60细胞显示出核断裂和核边聚见图 2中。当HL-60受147Pm辐照24h时, 可见膜包裹着的凋亡小体形成如图 3中所示。
|
图 1 正常HL -60细胞的透射电镜观察(×8000) |

|
图 2 147Pm辐照作用12h后的HL -60细胞透射电镜观察(×8000) |
|
图 3 147Pm辐照作用24h后的HL-60细胞透射电镜观察(×8000) |
观察到147Pm诱发的HL-60细胞凋亡可出现DNA核小体之间的随机性断裂。这是由于限制性核酸内切酶的作用, 在DNA琼脂糖凝胶电泳时, 显示出阶梯状电泳条带形成。提取了受到147Pm辐照不同时间的HL-60细胞的DNA, 进行琼脂糖凝胶电泳发现, 在受147Pm辐照作用达12和24h的HL-60细胞, 可呈现出明显的凋亡细胞特征的阶梯状条带见图 4中。

|
图 4 147Pm辐照不同时间的HL-60细胞DNA琼脂糖凝胶电泳 1.基准; 2.对照; 3. 147Pm 3h; 4. 147Pm 6h; 5. 147Pm 12h; 6. 147Pm 24h |
在本研究中, 我们观察到作为荧光涂料激发能源和在核辅助动力装置系统中广泛应用的β辐射体核素147Pm诱发人白血病HL-60细胞凋亡发生。由于内照射核素对组织细胞的损伤效应, 主要来自对大分子物质尤其是对DNA的直接损伤, 损伤的DNA可通过活化细胞内的DNA修复机制进行修复, 同时也能活化细胞的凋亡机制, 使无法修复的细胞经凋亡途径而死亡。细胞凋亡先出现DNA较大分子量的链断裂, 继而导致限制性内切酶的活化, 引起DNA在核小体间断裂, 这是由于此酶能选择性的切断核小体间的连接DNA, 使之成为不连续的多倍180~200 bp大小的DNA片断〔8〕, 从而会在琼脂糖凝胶电泳时出现阶梯状条带, 这将有利于进而从事于开展内照射辐照诱发细胞凋亡的量效关系的探讨。
| [1] |
朱寿彭. 辐射诱发细胞凋亡与基因调控[J]. 国际学术动态, 1996(3): 65-68. |
| [2] |
Szumiel I. Ionizing radiation induced cell death[J]. Int J Radiat Biol, 1994, 66(2): 329-341. |
| [3] |
Halford DK, Markham OD. Biological elimination rates of radioisotopes[J]. Health Phys, 1983, 45(4): 745-751. |
| [4] |
朱寿彭. 荧光涂料中钷的放射毒理[M]. 北京: 原子能出版社, 1994: 110-162.
|
| [5] |
张澜生, 王宁海. IL-2对60Co γ射线照射引起人血淋巴细胞增殖抑制的逆转效应[J]. 辐射防护, 1990, 10(3): 219-223. |
| [6] |
李士骏. 电离辐射剂量学[M]. 北京: 原子能出版社, 1981: 286.
|
| [7] |
卢圣栋. 现代分子生物学实验技术[M]. 北京: 高等教育出版社, 1993: 50-57.
|
| [8] |
Brown DG, Sun XM, Cohn GM. Dexamethasome induce apoptosis involves cleavage of DNA to internucleosomal fragmentation[J]. J Biol Chem, 1993, 268(19): 3037-3039. |


