外周血淋巴细胞染色体具有高度的辐射敏感性。染色体畸变分析可察觉早期的辐射损伤, 并用作“生物剂量计”估算辐射剂量〔1〕, 同时也是评价远后效应的重要指标。电离辐射诱发染色体畸变的转归及其生物学意义, 已引起学者们的重视, 在辐射致癌和遗传效应与染色体损伤关系的研究方面已积累了不少资料, 取得了较大进展。微核测试法, 作为染色体畸变分析的辅助指标, 不仅可以用作生物剂量估算, 而且在远后效应研究中也得到了广泛的应用。本文为过量受照人员照后15~26年细胞遗传学随访结果。
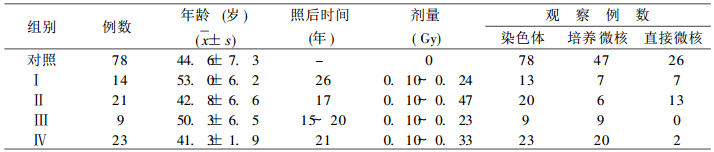
1 材料和方法 1.1 人员受照情况和分组本次共观察67例过量受照人员, 其中44例为一次性外照射, 根据受照时间和特点将其分为三组。Ⅰ组14例, 事故发生在1966年; Ⅱ组21例, 事故发生在1975年; Ⅲ组9例, 分散发生在1972~1977年。另23例为裂变产物的内污染, 发生在1971~1972年, 列为第Ⅳ组。Ⅰ至Ⅲ组剂量用胶片或玻璃剂量仪测量, 第Ⅳ组用整体测量估算。本次观察设配对对照组。剂量分组见表 1。所有受检人员均为男性。
|
|
表 1 受照人员的剂量和分组 |
采用微量全血法, 培养开始加秋水仙素, 最终浓度为0.03μg· ml-1, 37℃条件下培养48小时收获, 主要观察和记录染色体型畸变, 包括双或多着丝粒体、着丝粒和无着丝粒环、多余断片(末端缺失)、微小体和易位等。只计数46±1个着丝粒的细胞, 每例观察200个细胞, 一个观察者见到的畸变必由另一观察者予以审核。
1.2.2 微核① 常规培养法, 除培养时间为72小时和不加秋水仙素外, 其他同染色体培养。制片时, 加低渗液后立即固定, 使细胞膨胀而胞浆保持完整。每例观察2000个转化的淋巴细胞, 转化标准见参考文献〔2〕。结果以微核细胞率(‰)和微核率(‰)表示。
② 直接培养法, 取0.4ml肝素化静脉血, 加入0.2m l, 0.5%甲基纤维素, 混匀, 在37℃恒温箱中放置20~30分钟后, 吸出上清液并将其离心(1000rpm) 10分钟, 去上清, 沉降物涂片, Giemsa或苏木素染色, 每例观察2000个淋巴细胞, 以‰表示。
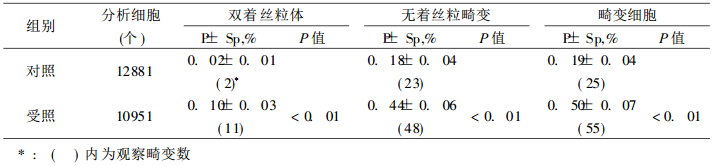
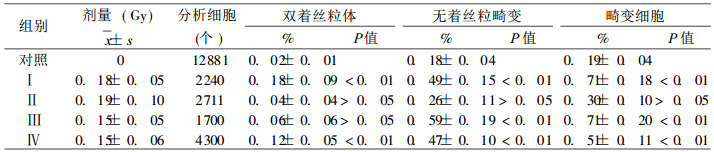
2 结果 2.1 染色体观察了65例受照者的10951个淋巴细胞的中期分裂相和78例对照的12881个中期分裂细胞, 将结果列于表 2。从表 2可见, 受照组各类染色体型畸变, 比对照组明显为高, 并有非常显著性差异。将各组染色体畸变结果列于表 3。从表 3可见, 平均剂量0. 15~0.19Gy照射后15~26年, 受照各组各类染色体型畸变仍比对照组为高, 多数指标差异有非常显著性意义。
|
|
表 2 受照组与对照组间染色体畸变的比较 |
|
|
表 3 各组染色体畸变率(P± Sp, %)及其与对照组间的显著性检验 |
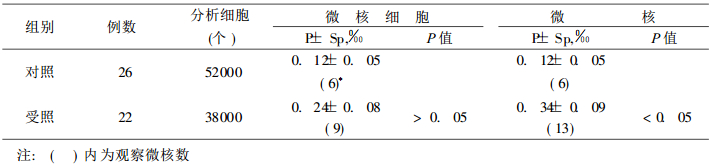
本次随访用该法只检查22例受照者和26例对照人员, 结果列于表 4。从表 4可见, 受照组微核细胞率和微核率, 都高于对照组, 两组间微核率差异有显著性意义。
|
|
表 4 受照组与对照组之间微核(直接法)的显著性检验 |
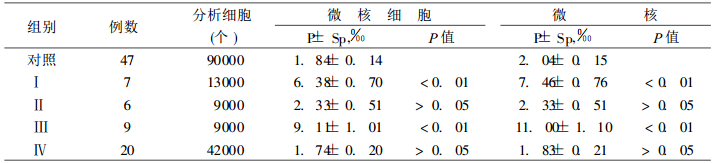
用该法检查受照组42例, 对照组47例, 共观察163000个转化的淋巴细胞, 受照组微核细胞率和微核率皆比对照组有显著意义的增加(见表 5)。
|
|
表 5 受照与对照组间常规培养法微核的显著性检验 |
将各组培养法微核列于表 6, 从该表可见, 除第Ⅳ组外, 其余各组微核细胞和微核率都比对照组为高, 其中第Ⅰ、Ⅲ组与对照组之间的差异有非常显著性意义
|
|
表 6 受照各组与对照组之间常规培养法微核率的比较 |
众所周知, 电离辐射诱发的染色体畸变, 主要包括结构畸变和数目异常。与剂量存在密切依赖关系的是结构畸变中的染色体型畸变。在事故剂量估算时, 主要应用双着丝粒体加着丝粒环等非稳定性畸变。非稳定性畸变随着时间的推移和细胞的分裂, 容易丢失, 故用“双十环”估算剂量最迟不能超过60天。而易位、倒位、缺失和插入等稳定性畸变, 不随细胞的分裂而丢失, 可较长时间存留在细胞内。所以, 在辐射远后效应观察及对先前照射剂量估算时, 主要观察稳定性畸变。
本次随访观察为照后15~26年, 此时受照组的染色体畸变率仍明显高于对照组, 这一结果与Awa (1971)〔3〕对原爆幸存者观察的结果较为一致。该作者共调查了213名原爆幸存者, 发现在受照23~24年时, 染色体畸变仍高于对照, 而且在低剂量组(1~99cGy)也观察到了染色体畸变, 畸变率与剂量呈线性关系。
Ohta ki等(1982)〔4〕比较研究了常规法和G-显带法染色体畸变的类型和频率, 该研究共选择了23例广岛原爆幸存者, 剂量在100cGy以上, 结果发现此时稳定性畸变检出率明显高于非稳定性畸变, G显带是观察稳定性畸变的良好方法。近年来发展起来的荧光原位杂交技术(FISH), 是辐射细胞遗传学中的新技术, 并已开始用于原爆幸存者和事故受照者易位频率的观察, 结果与G-显带接近〔5〕, 认为是一种有前途的方法。本随访理应采用G带方法, 但由于受检者分布在十几个省市和部队系统, 各实验室的条件不同, 故无法开展显带技术, 至于FISH方法, 费用昂贵, 目前尚无承受能力, 故不能运用于我们的研究中。此次观察, 采用培养开始加秋水仙素法, 分析第一次有丝分裂细胞, 除观察非稳定性畸变, 遇到明显的易位或缺失也进行记录, 考虑到辐射诱发白血病的问题, 特别注意对G组的观察, 未发现ph1染色体。通过本次随访结果, 表明在受照远期, 常规法染色体畸变分析, 仍可作为随访指标。当然, 随着我国国民经济的发展, 科研条件的改善, 尽早采用先进的技术和方法进行此类研究。
外周血淋巴细胞微核, 目前有三种方法。本随访早期采用直接法, 以后改用常规培养法。目前, 国内有些实验室已开展胞质分裂阻断法(CB法)〔6〕, 由于松胞素- B较贵, 承担此任务的实验室不全具备开展CB法的条件, 本次随访仍以常规培养法为主, 少数单位不能开展此法时, 则用直接法。本次随访, 剂量在0. 15Gy左右照后15~26年时, 微核率仍比对照组有显著意义的增加。笔者认为, 不具备开展CB法的条件下, 目前仍可采用常规培养法作为远后效应观察指标, 如果可能, 今后再随访时最好采用CB法, 使结果更灵敏和可靠。
本随访参加单位较多, 各实验室条件不尽相同, 协作组十分重视实验方法和判断标准的统一, 并设配对对照, 使所得数据更加可靠。
作者单位:卫生部工业卫生实验所, 国防科工委军事医学研究所, 北京放射医学研究所, 河南省职业病防治所, 四川省放射卫生防护所, 空军第四研究所, 山东省医学科学院放射医学研究所, 河北省放射卫生研究所, 同济医科大学核医学科, 陕西省卫生防疫站, 山西省卫生防疫站, 天津市职业病防治院, 内蒙古自治区放射卫生防护所。
执笔:白玉书(卫生部工业卫生实验所北京10088)。
| [1] |
Technical Report Series No.260.Biological dosimetry: Chromosomal aberration analysis for dose assessment.IAEA, Vienna, 1986.
|
| [2] |
白玉书, 张秀霞, 关树荣. 60Coγ线照射离体血诱发的淋巴细胞微核率与剂量关系[J]. 遗传, 1982, 4(3): 7. |
| [3] |
Awa AA, Neriishi S, Honda MC, et al. Chromosome- aberration frequency in cultured blood - cells in relation to radiation dose of A- bomb survivors[J]. Lancet, 1971, 2: 903. |
| [4] |
Ohtaki K, Shimba H, Awa AA, et al. Com parison of type and frequency of chromosome aberrations by conventional and G-staining mothods in Hiroshima atomic bomb survivors[J]. J Radiat Res, 1982, 23: 441. DOI:10.1269/jrr.23.441 |
| [5] |
Lucas JN, Awa A, Straume T, et al. Rapid translocation frequency analysis in humans decades after exposure to ionizing radiation[J]. Int J Radiat Biol, 1992, 62(1): 53. DOI:10.1080/09553009214551821 |
| [6] |
Fenech M, Morley AA. Measurement of micronuclei in lymphocytes[J]. Mutat Res, 1985, 147: 29. DOI:10.1016/0165-1161(85)90015-9 |