人和啮齿类细胞的HPRT基因位于X染色体上, 其基因产物为次黄嘌呤鸟嘌呤磷酸核糖转移酶(HPRT)。此酶特异性不强, 可把嘌呤类似物(如6-TG)掺入到DNA中引起细胞死亡, 当HPRT基因发生突变时, 突变细胞对嘌呤类似物不再敏感, 表现出抗性。细胞质分裂阻滞法(CB法), 即在培养物中加入细胞松弛素B(Cyt-B), 它使细胞质分裂受阻而对细胞核分裂没有影响〔1, 2〕。因而, 通过计数双核或多核细胞, 就能确定细胞群体中能进行分裂的存活细胞数。我们利用此法对辐射诱发体外培养的人胚肺细胞HPRT基因位点突变进行了观察, 为本实验室进行电离辐射诱发细胞转化的研究, 提供一个技术指标。
1 材料与方法 1.1 细胞及培养条件 1.1.1 人胚肺细胞(HEL-9402)取自水囊引产6个月龄女性胎儿肺组织, 染色体为正常二倍体核型。
1.1.2 培养液为含20%小牛血清的RPMI-1640 (美国)培养基。
1.2 作用因子本所60Coγ射线辐射源。
1.3 操作步骤取第五代生长旺盛期细胞, 分6个组进行照射, 照射剂量分别为0、0.25、0.5、1.0、3.0和5.0 Gy, 照后继续培养。取照后第4代细胞, 每组10瓶, 其中5瓶加入6-TG, 终浓度为0.1mM, 37℃恒温箱中培养。当培养到30h, 每瓶加细胞松弛素B(Cyt-B)终浓度为6μg/ml, 继续培养至72h, 收获细胞、制片、5% Giemsa染色、显微镜检。
1.4 突变子数的计算每1000个存活细胞中突变子数定义为, TG培养中每1000个细胞中双核或多核细胞数除以不含TG培养的1000个细胞中双核或多核细胞数。
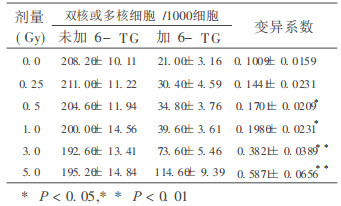
2 结果用CB法检测辐射致体外培养的HEL-9402细胞HPRT基因位点突变系数见附表。从表中可以看出, 随着照射剂量升高, 其HEL-9402细胞HPRT基因变突子数也随之升高。经统计处理, 剂量为0.25Gy组与对照组比较差别不显著, 但剂量在0.5~5.0 Gy与对照组比较均差别显著。
|
|
附表 辐射致HEL-9402细胞HPRT基因突变 |
目前公认HPRT是一个对电离辐射比较敏感的基因位点。当细胞中HPRT基因位点改变时, 通过检测体细胞中6-硫代鸟嘌呤(6-TG)抗性出现的频率, 就可确定体细胞中HPRT基因位点的突变频率。文献证实〔3〕, HPRT基因位点突变与电离辐射之间存在着良好的量效关系, 而且引起的突变不是由于转录被阻断, 而是真正的不可逆的突变。因此, 常把检测HPRT基因位点突变, 作为研究电离辐射与化学致癌剂潜在危险的观察指标。
用Cyt-B阻断细胞质分裂, 使对6-TG具有抗性的突变性, 在体外培养72小时, 形成双核和多核细胞。从本实验结果看, CB法检测辐射致人胚肺细胞HPRT基因位点突变与辐射剂量呈现良好的线性关系。表明CB法可检测辐射致人胚肺细胞HPRT基因位点突变, 此法与其他方法相比具有易观察辨别、培养时间短、方法简便、易掌握等优点。
| [1] |
Amos Norman, et al. A sensitive assay for 6-thioguanine - resistant lymphocytes[J]. Mutation Research, 1988, 208: 17. |
| [2] |
王知权, 等. 一种快速, 灵敏测定人体HPRT基因位点的改进方法[J]. 癌变·畸变·突变, 1991, 3(3): 56. |
| [3] |
王玉书, 李艳红. 体细胞HPRT基因位点突变在电离辐射研究中的应用潜势[J]. 国外医学·放射医学核医学分册, 1990, 14(3): 100. |